Содержание
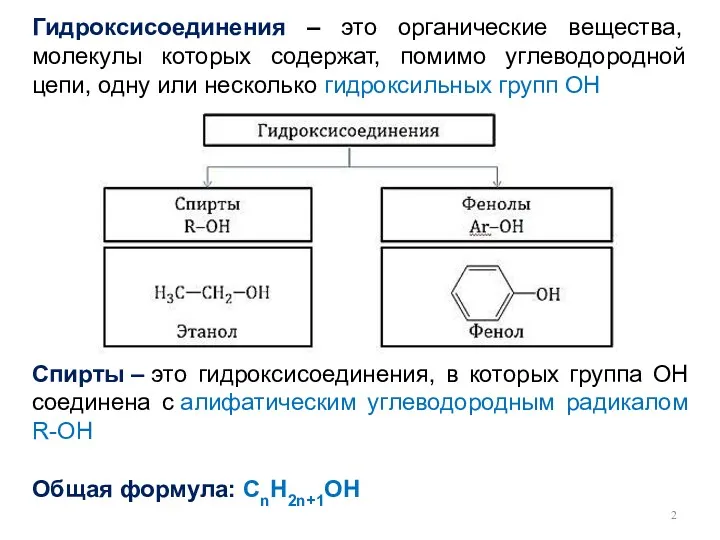
- 2. Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп
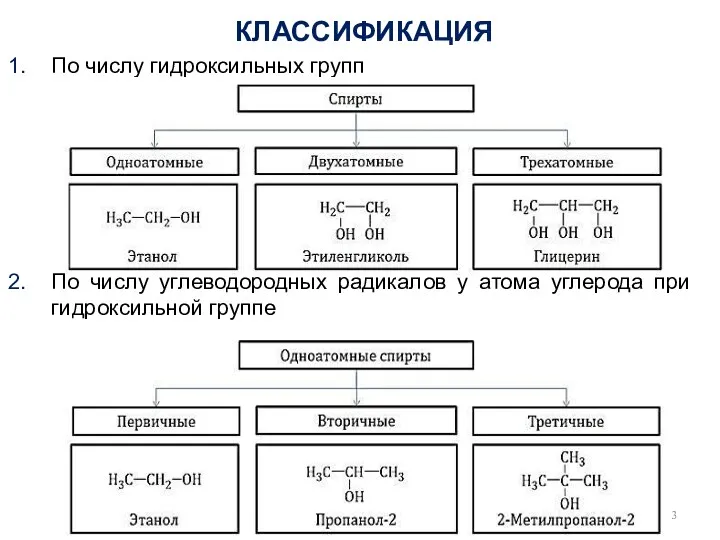
- 3. КЛАССИФИКАЦИЯ По числу гидроксильных групп По числу углеводородных радикалов у атома углерода при гидроксильной группе
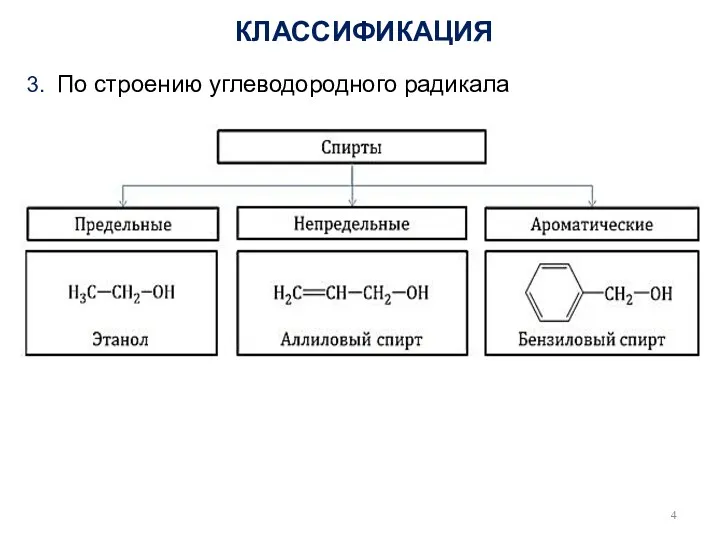
- 4. 3. По строению углеводородного радикала КЛАССИФИКАЦИЯ
- 5. НОМЕНКЛАТУРА По систематической номенклатуре к названию углеводорода добавляют суффикс «-ОЛ» и цифру, указывающую номер атома углерода,
- 6. В названиях многоатомных спиртов количество групп ОН указывают суффиксами -диол в при наличии двух ОН-групп, -триол
- 7. ИЗОМЕРИЯ СПИРТОВ 1. Для спиртов характерна структурная изомерия – изомерия углеродного скелета – изомерия положения гидроксильной
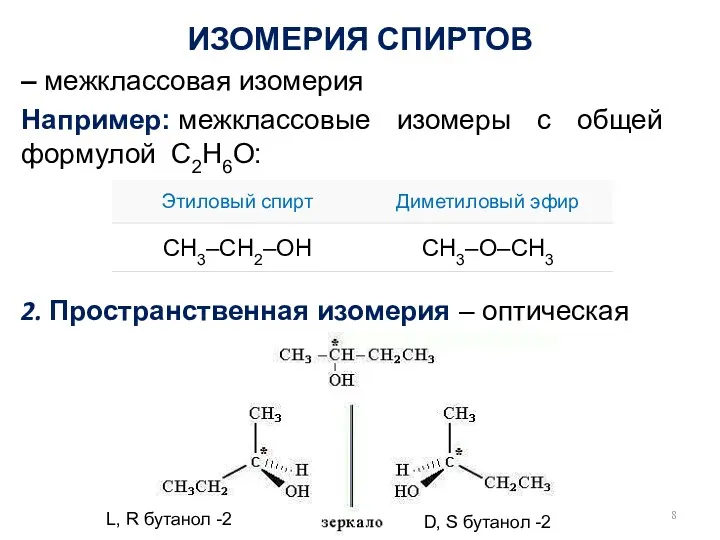
- 8. – межклассовая изомерия Например: межклассовые изомеры с общей формулой С2Н6О: 2. Пространственная изомерия – оптическая ИЗОМЕРИЯ
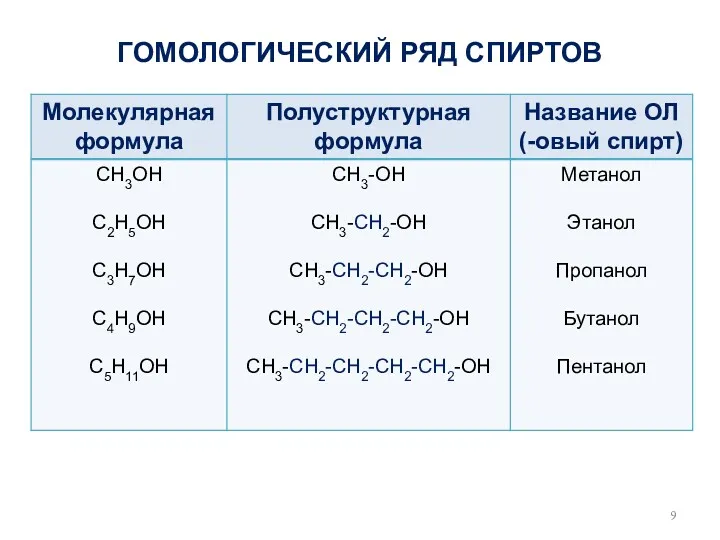
- 9. ГОМОЛОГИЧЕСКИЙ РЯД СПИРТОВ
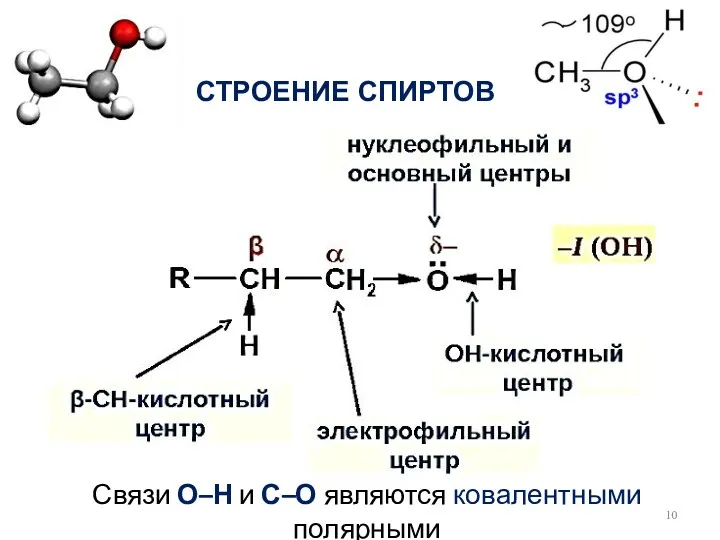
- 10. СТРОЕНИЕ СПИРТОВ Связи О–Н и С–О являются ковалентными полярными
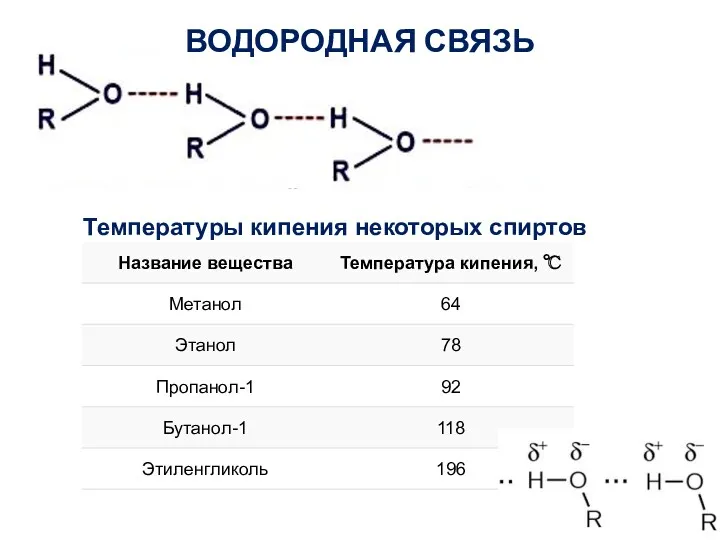
- 11. ВОДОРОДНАЯ СВЯЗЬ Температуры кипения некоторых спиртов
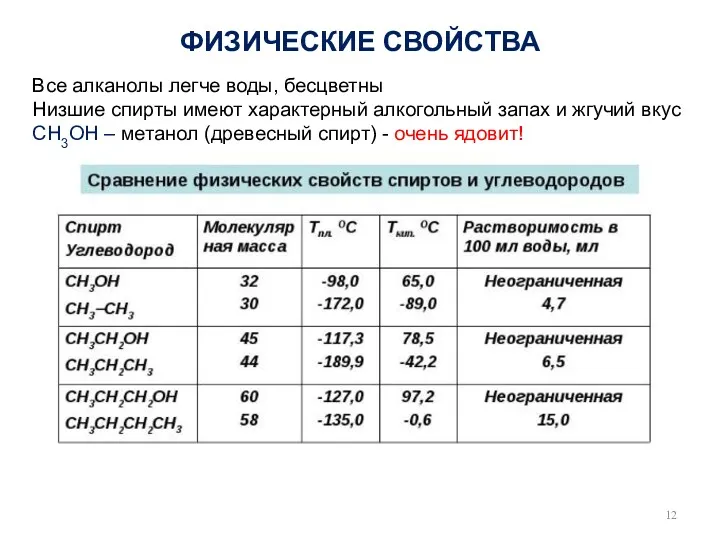
- 12. ФИЗИЧЕСКИЕ СВОЙСТВА Все алканолы легче воды, бесцветны Низшие спирты имеют характерный алкогольный запах и жгучий вкус
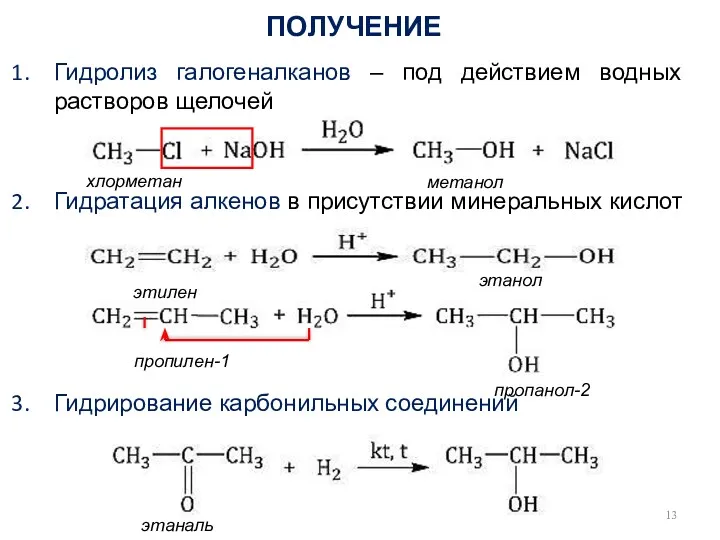
- 13. ПОЛУЧЕНИЕ Гидролиз галогеналканов – под действием водных растворов щелочей Гидратация алкенов в присутствии минеральных кислот Гидрирование
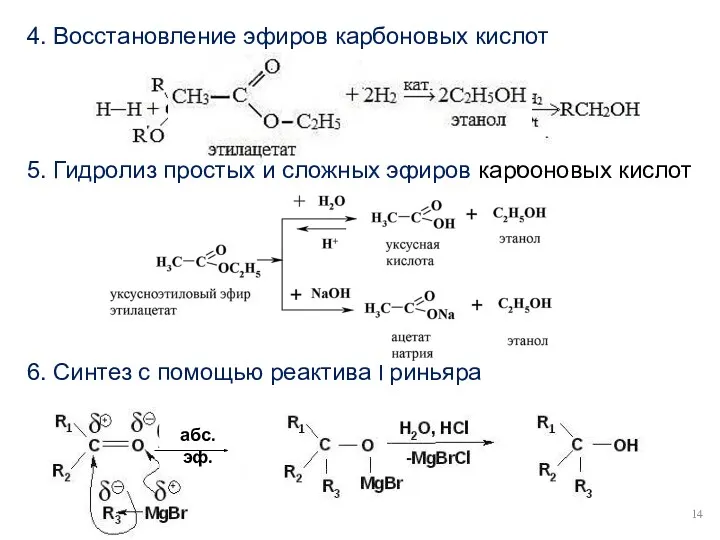
- 14. 4. Восстановление эфиров карбоновых кислот 5. Гидролиз простых и сложных эфиров карбоновых кислот 6. Синтез с
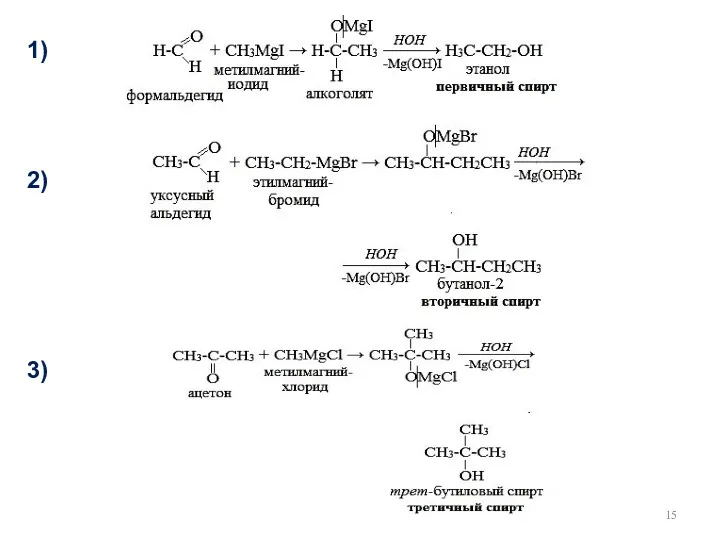
- 15. 1) 2) 3)
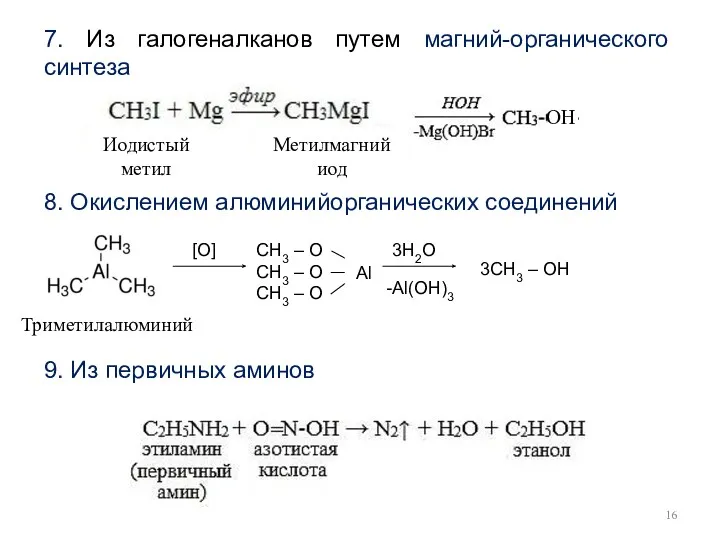
- 16. 7. Из галогеналканов путем магний-органического синтеза 8. Окислением алюминийорганических соединений 9. Из первичных аминов ОН [O]
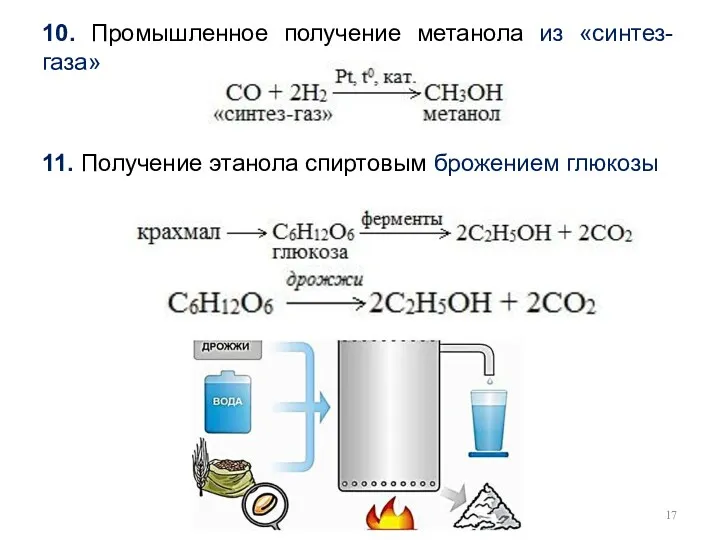
- 17. 10. Промышленное получение метанола из «синтез-газа» 11. Получение этанола спиртовым брожением глюкозы
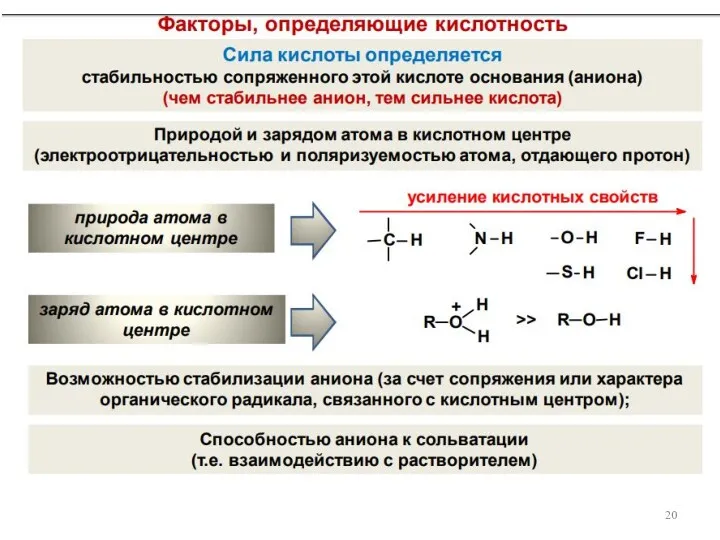
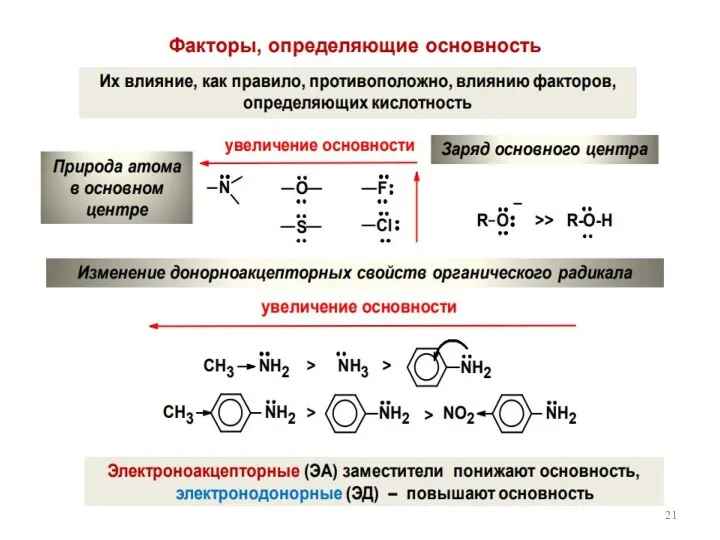
- 18. КИСЛОТНЫЕ И ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Теории кислот и оснований: – теория электролитической диссоциации (Аррениус) –
- 19. Теория Льюиса (1925 г.)
- 22. КОНЦЕПЦИЯ ПИРСОНА
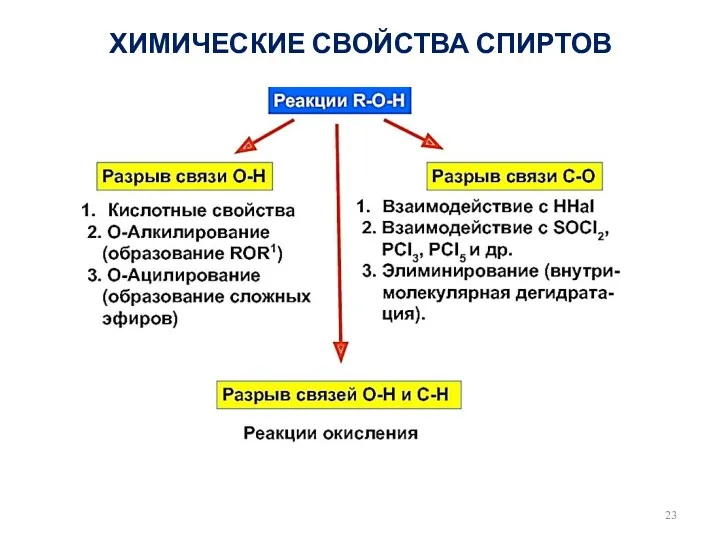
- 23. ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ
- 24. Кислотные свойства Взаимодействие с металлами Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные
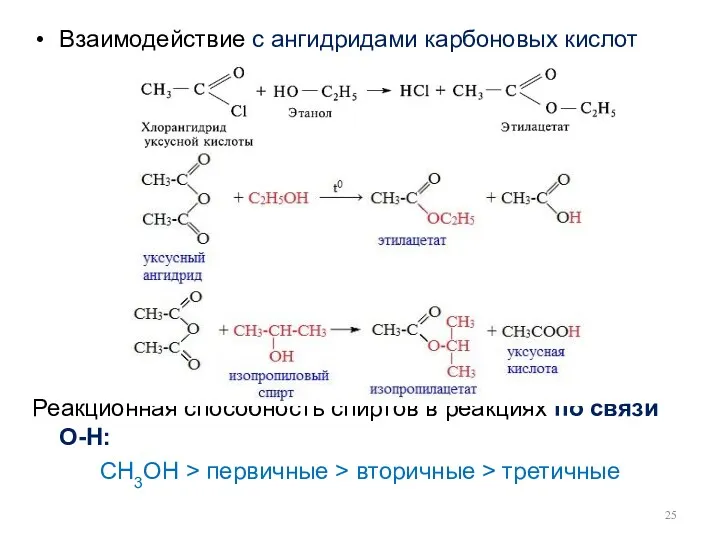
- 25. Взаимодействие с ангидридами карбоновых кислот Реакционная способность спиртов в реакциях по связи О-Н: CH3OH > первичные
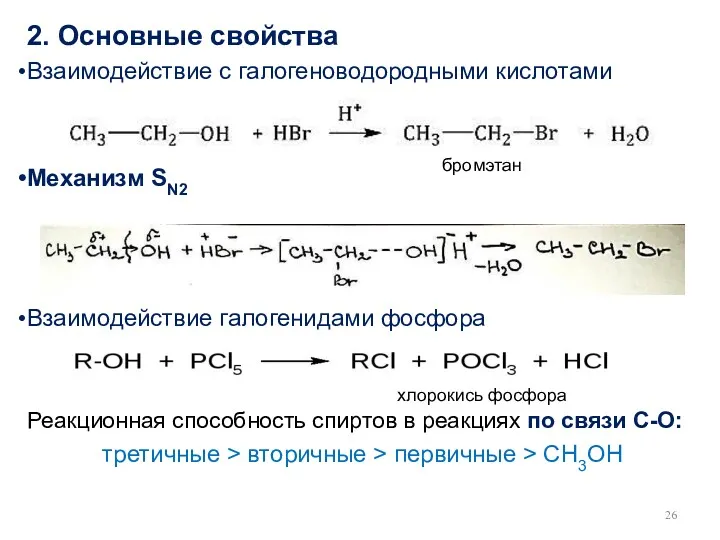
- 26. 2. Основные свойства Взаимодействие с галогеноводородными кислотами Механизм SN2 Взаимодействие галогенидами фосфора Реакционная способность спиртов в
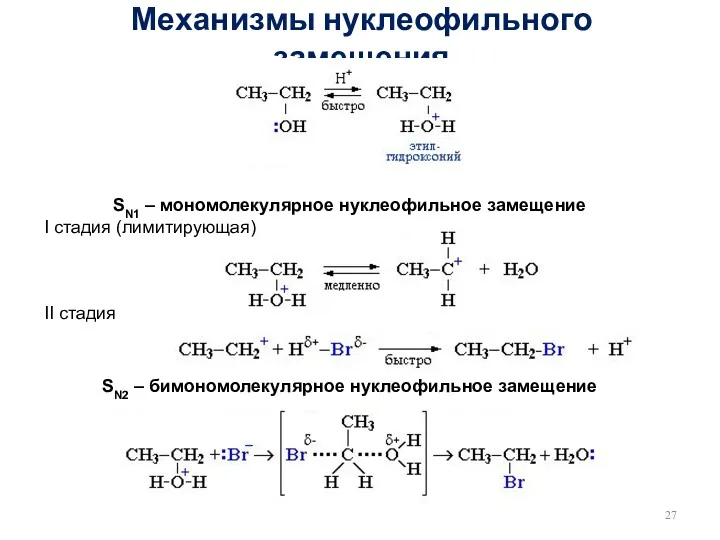
- 27. Механизмы нуклеофильного замещения SN1 – мономолекулярное нуклеофильное замещение I стадия (лимитирующая) II стадия SN2 – бимономолекулярное
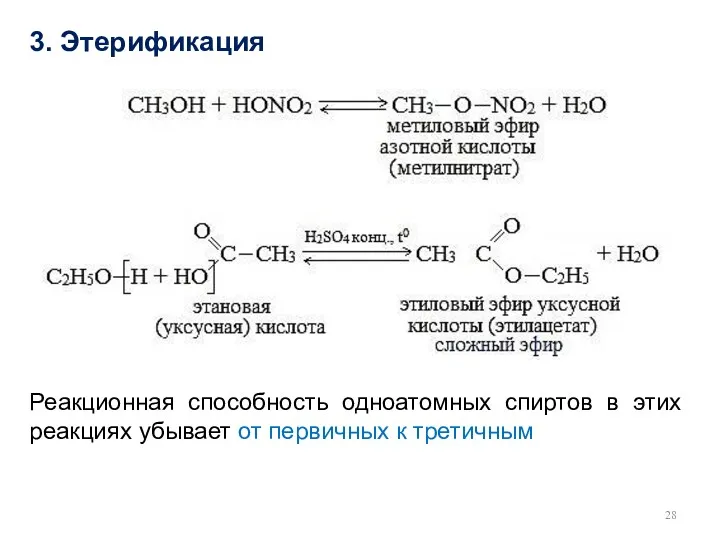
- 28. 3. Этерификация Реакционная способность одноатомных спиртов в этих реакциях убывает от первичных к третичным
- 29. 4. Реакции отщепления Межмолекулярная дегидратация Внутримолекулярная дегидратация Дегидратация вторичных и третичных спиртов происходит по правилу Зайцева:
- 30. Дегидрирование а) При дегидрировании первичных спиртов образуются альдегиды б) При дегидрировании вторичных спиртов образуются кетоны в)
- 31. 5. Реакции окисления Типичные окислители – оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии
- 32. Горение (полное окисление) Неполное окисление В присутствии окислителей [O] –K2Cr2O7 или KMnO4 спирты окисляются до карбонильных
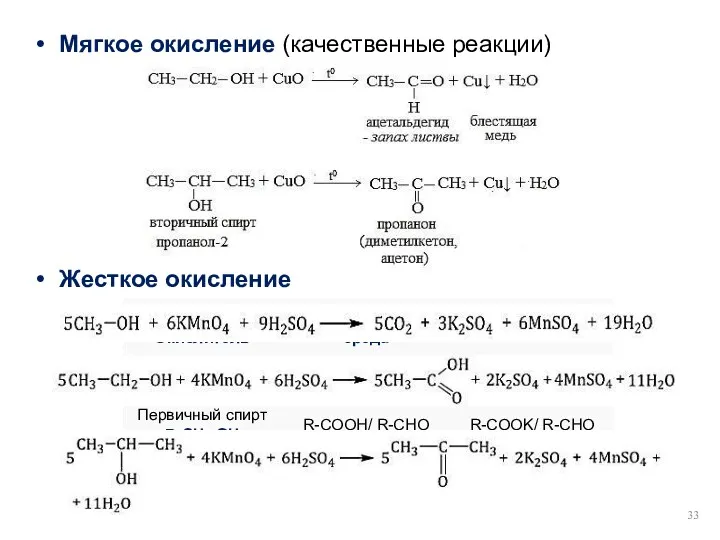
- 33. Мягкое окисление (качественные реакции) Жесткое окисление
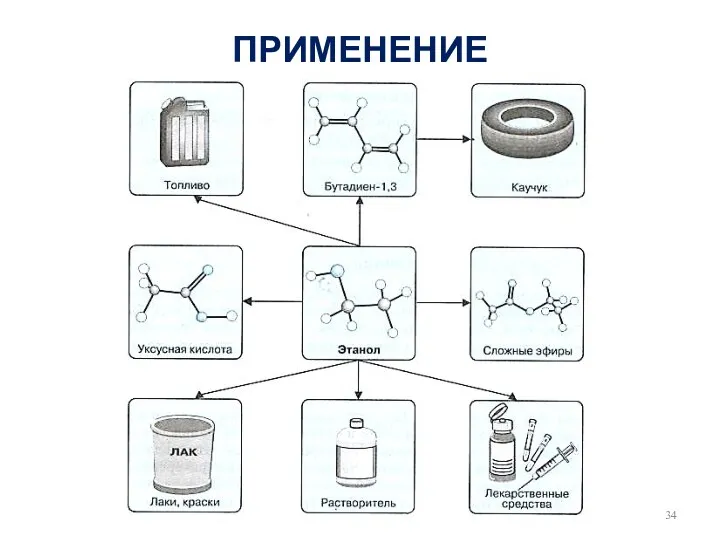
- 34. ПРИМЕНЕНИЕ
- 35. СПАСИБО ЗА ВНИМАНИЕ!
- 36. ЯДОВИТОСТЬ СПИРТОВ Метиловый спирт – сильный яд! Несколько граммов его, попав в организм человека, вызывает слепоту,
- 38. Скачать презентацию










![Горение (полное окисление) Неполное окисление В присутствии окислителей [O] –K2Cr2O7](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/171284/slide-31.jpg)


 Чистые вещества и смеси
Чистые вещества и смеси Вода-растворитель. Работа воды в природе
Вода-растворитель. Работа воды в природе Щелочные металлы
Щелочные металлы The alkali metals
The alkali metals Предмет органической химии
Предмет органической химии Приготування розчинів
Приготування розчинів Периодическая система Д.И. Менделеева
Периодическая система Д.И. Менделеева Энергоресурсы и их использование
Энергоресурсы и их использование Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Химические соединения в организме человека
Химические соединения в организме человека Углеводы. Моносахариды
Углеводы. Моносахариды Карбоновые кислоты. Нахождение в природе
Карбоновые кислоты. Нахождение в природе Электростатические взаимодействия, как фактор, определяющий структуру и реакционную способность органических соединений
Электростатические взаимодействия, как фактор, определяющий структуру и реакционную способность органических соединений Химические формулы
Химические формулы Задачі на визначення ступеню електролітичної дисоціації
Задачі на визначення ступеню електролітичної дисоціації Закон збереження маси речовини. Хімічні рівняння
Закон збереження маси речовини. Хімічні рівняння Методы составления уравнений окислительно-восстановительных реакций. Лекция №20
Методы составления уравнений окислительно-восстановительных реакций. Лекция №20 История мыловарения. Моющее действие мыла
История мыловарения. Моющее действие мыла Чистые вещества и смеси
Чистые вещества и смеси Подготовка к ГИА. В3. Степень окисления химических элементов. Окислительно-восстановительные реакции
Подготовка к ГИА. В3. Степень окисления химических элементов. Окислительно-восстановительные реакции Добування кисню
Добування кисню Основы теории смазывания и стандарты качества моторных масел
Основы теории смазывания и стандарты качества моторных масел Гидроксид аммония
Гидроксид аммония Structural revision of (+)-uprolide F diacetate confirmed by asymmetric total synthesis
Structural revision of (+)-uprolide F diacetate confirmed by asymmetric total synthesis Кислород O2
Кислород O2 Химия и живопись
Химия и живопись Кислородные соединения азота
Кислородные соединения азота Бор шикізатын қышқылдық ыдырату
Бор шикізатын қышқылдық ыдырату