Содержание
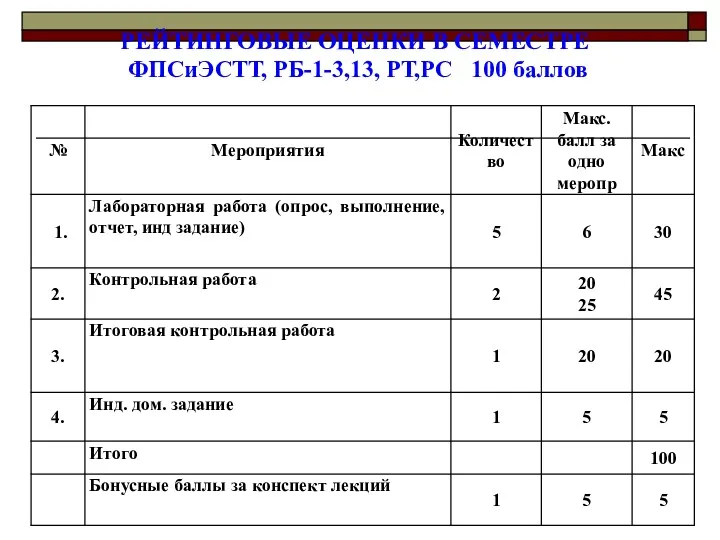
- 2. РЕЙТИНГОВЫЕ ОЦЕНКИ В СЕМЕСТРЕ ФПСиЭСТТ, РБ-1-3,13, РТ,РС 100 баллов
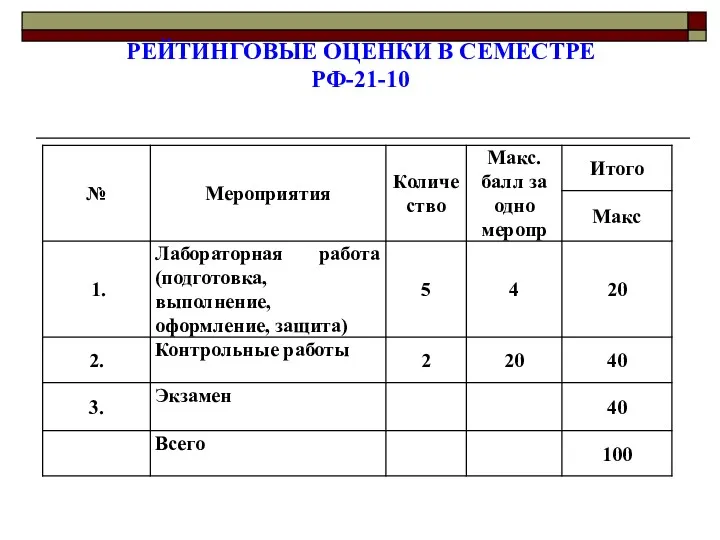
- 3. РЕЙТИНГОВЫЕ ОЦЕНКИ В СЕМЕСТРЕ РФ-21-10
- 4. - дифференцированный зачёт (ФПСиЭСТТ, РБ-21-1-3,13, РТ, РС), - экзамен (РФ) 50 – 69 баллов удовлетворительно 70
- 5. Старостам групп написать письмо доценту Тюменовой С.И. sv.tyumenova@gmail.com 2. Материалы по учебному процессу будут выложены на
- 6. 2. Приобрести халаты для работы в практикуме. 3. Взять в библиотеке или приобрести в «Аргументе» Лабораторный
- 7. Список литературы Основная литература: 1. Глинка Н.Л. Общая химия: Учеб. для студентов нехим. спец. вузов /
- 8. Дополнительная литература: Лабораторный практикум по общей и неорганической химии: Учебное пособие для специалистов и бакалавров нехимических
- 9. 4. Солодова Е.В., Зайцева Ю.Н., Дедов А.Г. Избранные главы общей химии. Основные закономерности протекания химических реакций:
- 10. Предмет химии. Основные задачи курса Химия - это наука, изучающая процессы превращения веществ, сопровождающиеся изменением состава
- 11. План лекции Основные понятия химии Основные законы химии Закон эквивалентов
- 12. Тема 1. Основные понятия химии
- 13. Окружающий нас мир представлен материей, которая имеет две формы существования: вещество и поле. Вещество – это
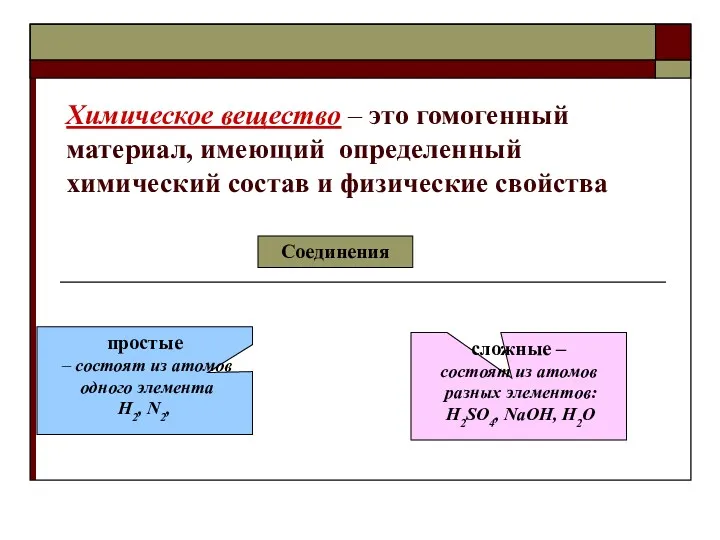
- 14. Химическое вещество – это гомогенный материал, имеющий определенный химический состав и физические свойства Соединения простые –
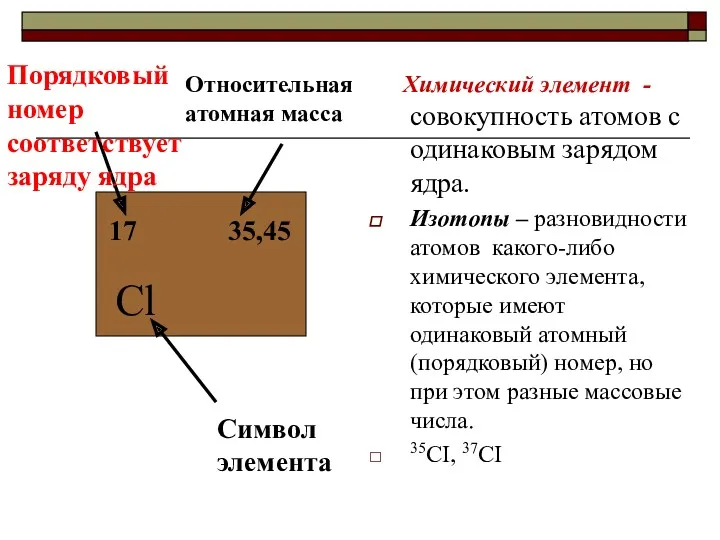
- 15. Химический элемент - совокупность атомов с одинаковым зарядом ядра. Изотопы – разновидности атомов какого-либо химического элемента,
- 16. Атом – наименьшая частица химического элемента, сохраняющая все его химические свойства. Атомная масса – масса одного
- 17. Молекула – мельчайшая частица химического вещества, обладающая его химическими свойствами. Молекулярная масса – масса одной молекулы.
- 18. Количество вещества определяется числом структурных единиц (атомов, молекул, ионов или других частиц) этого вещества, оно обозначается
- 19. Один моль железа и аспирина. Железные гвозди весят 56 г и содержат 6,02 х1023 атомов Fe.
- 20. Пример 1. Найти массу атома натрия Na Решение: Молярная масса натрия М(Na) = 23 г/моль. 6,02·
- 21. Пример 2. Сколько молекул содержится в 6,4 г оксида серы (IV)? Решение: 1. Молярная масса оксида
- 22. Индивидуальные вещества и смеси Индивидуальное вещество – это вещество, состоящее из химических частиц, одинаковых по составу
- 23. Физические и химические явления Физические явления – явления, при которых внутреннее строение, состав и свойства не
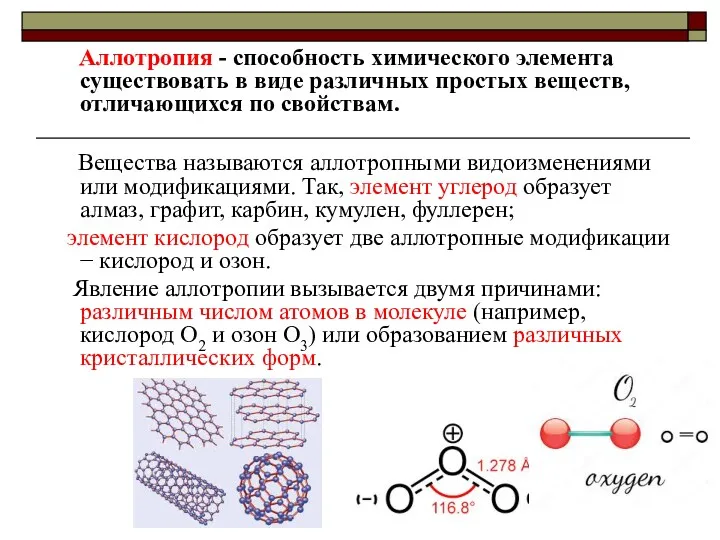
- 24. Аллотропия - способность химического элемента существовать в виде различных простых веществ, отличающихся по свойствам. Вещества называются
- 25. Молярный объем Молярный объем Vm - объём одного моля газообразного вещества Vm = V/ n Vm
- 26. 2. Основные законы химии
- 27. Закон сохранения массы вещества (Ломоносов - Лавуазье, 1756 - 1789) 4Fe + 3O2 = 2 Fe2O3
- 28. Антуан Лоран Лавуазье (1743 -1794) 1772 г. - открыл кислород. 1789 г. - открыл закон сох-ранения
- 29. Михаил Васильевич Ломоносов (1711 - 1765) 1741 г. - сформулировал ос-новные положения корпус-кулярной теории строения вещества.
- 30. Закон постоянства состава (Жозеф Луи Пруст, 1801 -1808) Все индивидуальные вещества имеют постоянный качественный и количественный
- 31. Закон кратных отношений (Дж. Дальтон, 1803 г.) Если два химических элемента дают несколько соединений, то весовые
- 32. Закон объемных отношений (Ж.Гей-Люссак, 1808 г) При одинаковых условиях (t, p) объемы вступающих в реакцию газов
- 33. Закон Авогадро (А.Авогадро, 1811 г.) В равных объемах любых газов, взятых при одной и той же
- 34. 3. Закон эквивалентов (В. Рихтер, 1791 - 1798 г) Вещества взаимодействуют друг с другом и образуются
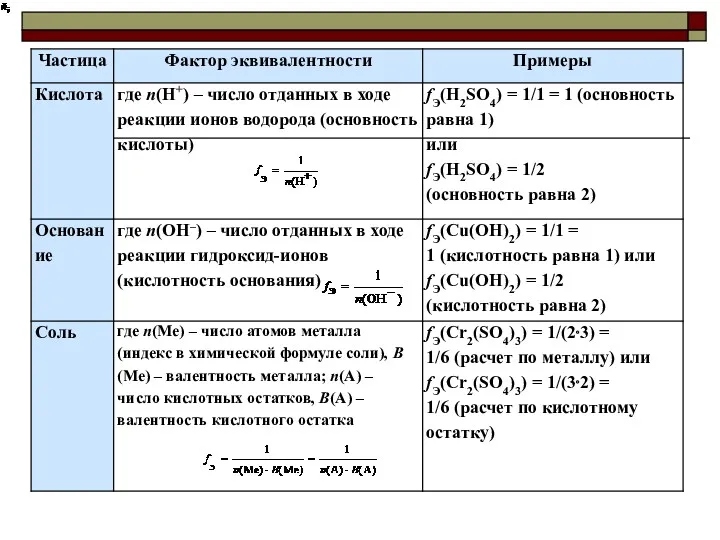
- 35. Химический эквивалент – реальная или условная частица вещества, которая в кислотно-основной реакции эквивалентна (т.е. химически равноценна)
- 36. Рассмотрим реакцию: H3PO4 + KOH = KH2PO4 + H2O по определению эквивалентом H3PO4 будет являться молекула
- 37. Рассмотрим реакцию: H3PO4 + 2KOH = K2HPO4 + 2H2O по определению эквивалентом H3PO4 будет являться условная
- 38. Рассмотрим реакцию: H3PO4 + 3KOH = K3PO4 + 3H2O по определению эквивалентом H3PO4 будет являться условная
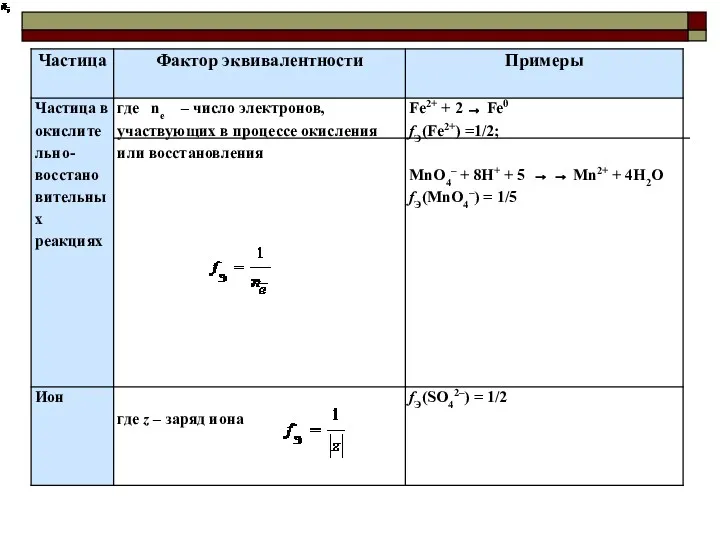
- 39. Фактор эквивалентности (fэкв) – число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту fэкв
- 40. Число эквивалентности z Число эквивалентности (эквивалентное число) z показывает, какое число эквивалентов вещества условно «содержится» в
- 44. Вопросы к лекции Дайте определения понятиям химическое вещество, смесь, материал. Чем отличаются индивидуальные вещества от смесей?
- 46. Скачать презентацию




































 Цікаві історичні факти з походження назв хімічних елементів
Цікаві історичні факти з походження назв хімічних елементів Структурно-механические свойства дисперсных систем
Структурно-механические свойства дисперсных систем Мытье головы
Мытье головы Chemical kinetics
Chemical kinetics Нітроген
Нітроген Гидролиз солей
Гидролиз солей Гетероциклдық қосылыстардың туындылары
Гетероциклдық қосылыстардың туындылары Моделирование, как метод научного исследования. Ограниченный метод Хартри-Фока
Моделирование, как метод научного исследования. Ограниченный метод Хартри-Фока Ароматические соединения. Тема № 5
Ароматические соединения. Тема № 5 Альдегиды и кетоны. Циветон
Альдегиды и кетоны. Циветон Составление формул химических соединений
Составление формул химических соединений Понятие о СМС и моющем процессе
Понятие о СМС и моющем процессе Биохимия. Критерии оценки косметических средств. Лекция 4. Индустрия красоты
Биохимия. Критерии оценки косметических средств. Лекция 4. Индустрия красоты Качественное определение химических элементов в почве
Качественное определение химических элементов в почве Электролиз
Электролиз 20190430_otkrytyy_urok_kislotypptx
20190430_otkrytyy_urok_kislotypptx Галогени. Знаходження в природі
Галогени. Знаходження в природі Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Теория электролитической диссоциации
Теория электролитической диссоциации Спирты. Классификация спиртов
Спирты. Классификация спиртов Такой разный песок
Такой разный песок Изучение свойств горных пород, минералов и полезных ископаемых
Изучение свойств горных пород, минералов и полезных ископаемых Химический состав Земли
Химический состав Земли Значення хімічних процесів у природі
Значення хімічних процесів у природі Щелочные металлы
Щелочные металлы Экспериментально исследовательский проект Соль волшебница
Экспериментально исследовательский проект Соль волшебница Таблица Менделеева
Таблица Менделеева Закон сохранения массы веществ
Закон сохранения массы веществ