Содержание
- 3. Нітроген
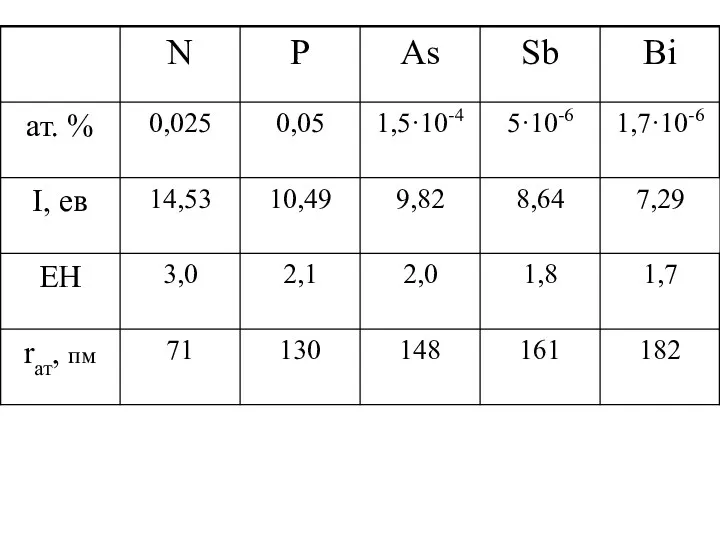
- 4. Переважна більшість нітрогену (99,8%) зосереджена в атмосфері у вигляді простої речовини N2 Маса цього азоту -
- 5. Добування В промисловості – ректифікація скрапленого повітря t кип (N2) = -195,80С t кип (O2) =
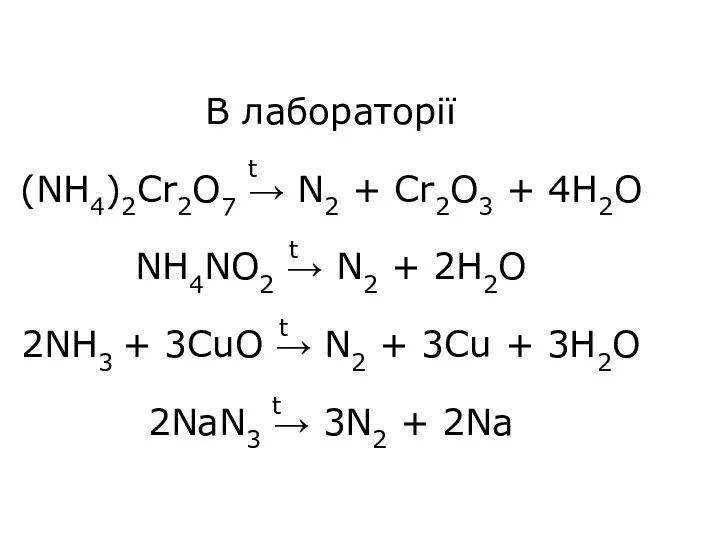
- 6. В лабораторії (NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O NH4NO2 → N2 + 2H2O 2NH3 +
- 7. Азот – газ без кольору і запаху Молекула – двохатомна, має малий розмір і низьку здатність
- 8. N≡N Довжина зв’язку (N≡N) – 110 пм Енергія зв’язку (N≡N) – 942 кДж/моль (N–N) – 160
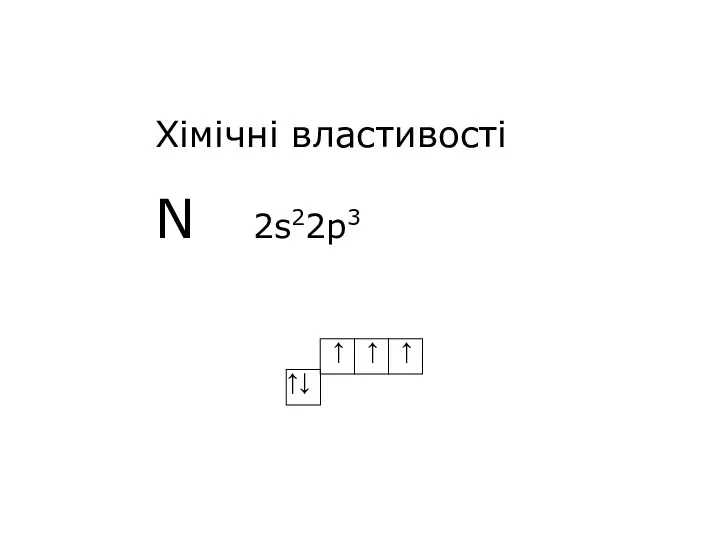
- 9. Хімічні властивості N 2s22p3
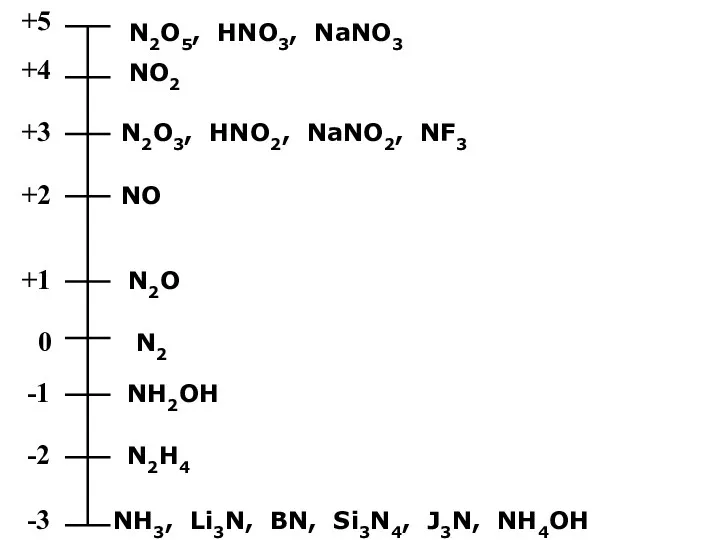
- 10. +5 +3 N2O3, HNO2, NaNO2, NF3 +4 +2 NO +1 N2O -1 NH2OH -2 N2H4 -3
- 11. За звичайних умов 6Li + N2 = 2Li3N – нітрид літію За нагрівання реагує з багатьма
- 12. 2B + N2 → 2BN N2 + 3H2 ⇆ 2NH3 ∆H P,T,Kat P,T,Kat t
- 13. Сполуки нітрогену з металами Нітриди металів не відносяться до солей (на відміну від галогенідів та сульфідів)
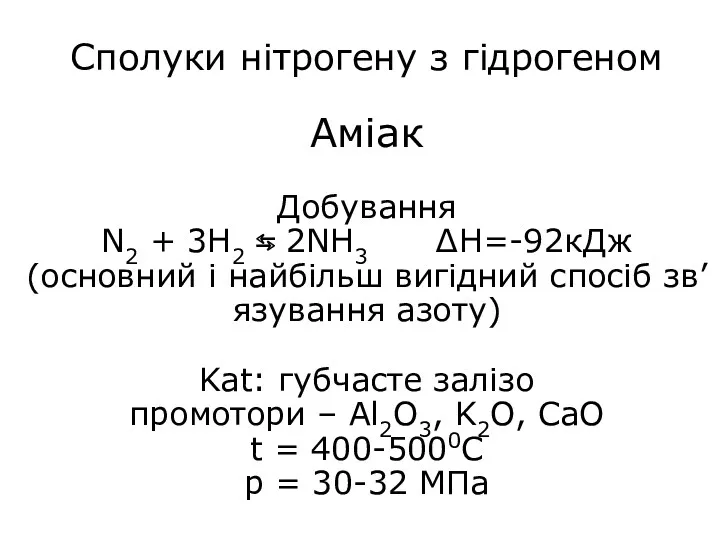
- 14. Сполуки нітрогену з гідрогеном Аміак Добування N2 + 3H2 ⇆ 2NH3 ∆H=-92кДж (основний і найбільш вигідний
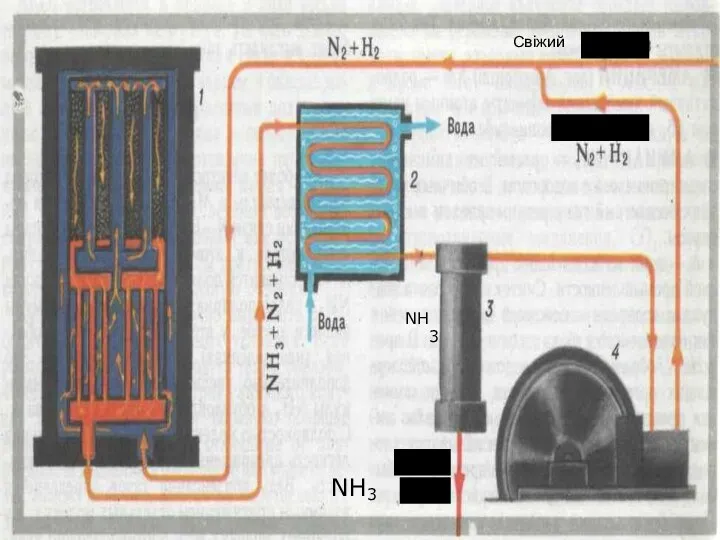
- 15. NH3 Свіжий NH3
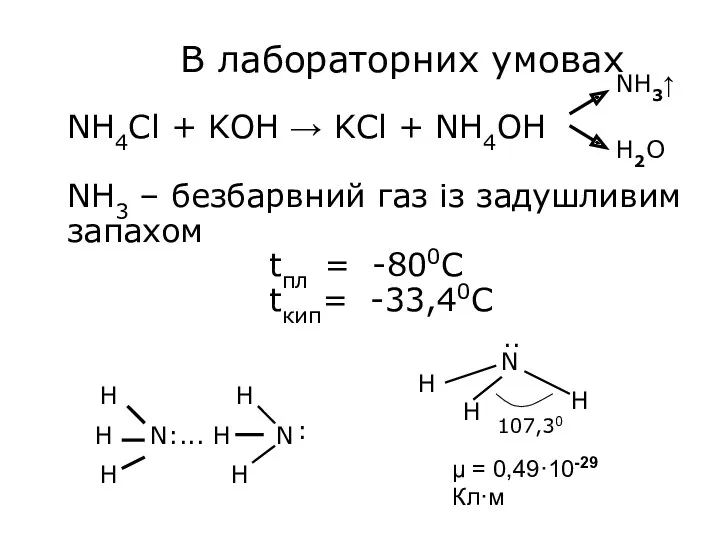
- 16. В лабораторних умовах NH4Cl + KOH → KCl + NH4OH NH3 – безбарвний газ із задушливим
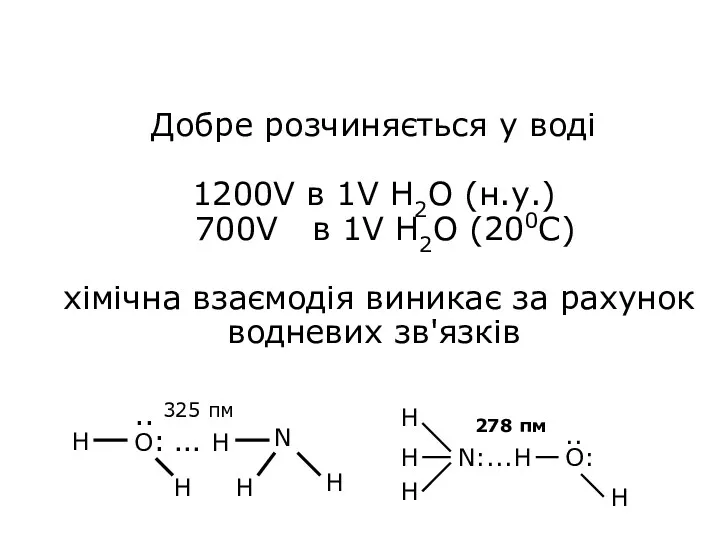
- 17. Добре розчиняється у воді 1200V в 1V H2O (н.у.) 700V в 1V H2O (200C) хімічна взаємодія
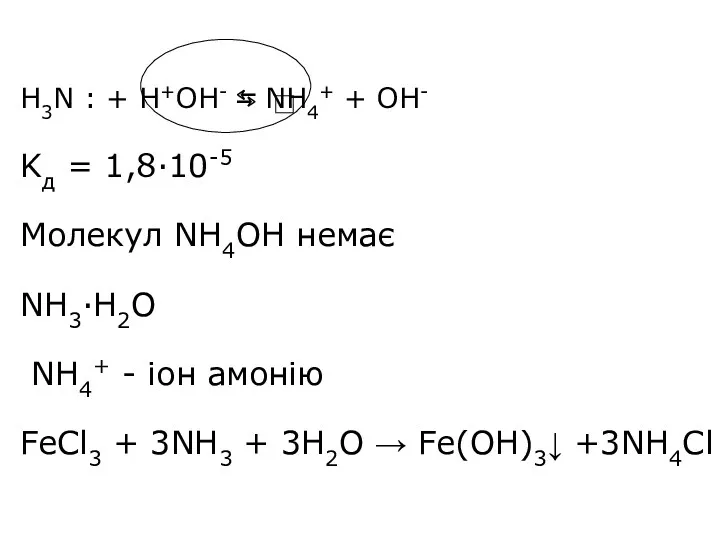
- 18. H3N : + H+OH- ⇆ NH4+ + OH- Kд = 1,8·10-5 Молекул NH4OH немає NH3∙H2O NH4+
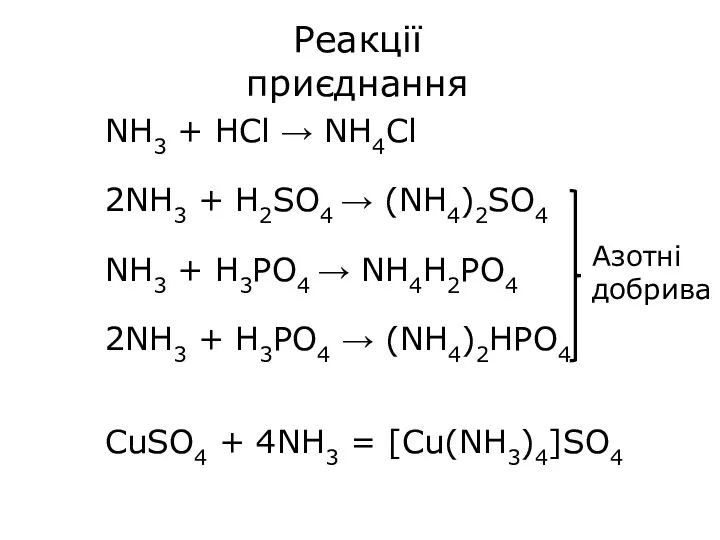
- 19. NH3 + HCl → NH4Cl 2NH3 + H2SO4 → (NH4)2SO4 NH3 + H3PO4 → NH4H2PO4 2NH3
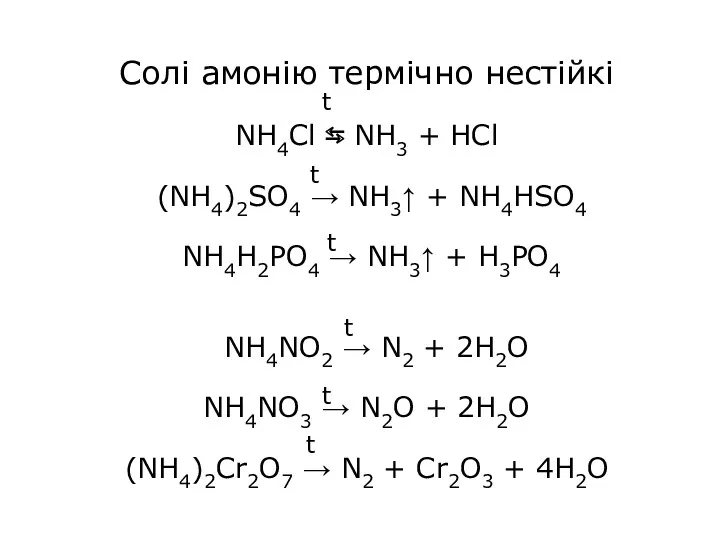
- 20. Солі амонію термічно нестійкі NH4Cl ⇆ NH3 + HCl (NH4)2SO4 → NH3↑ + NH4HSO4 NH4H2PO4 →
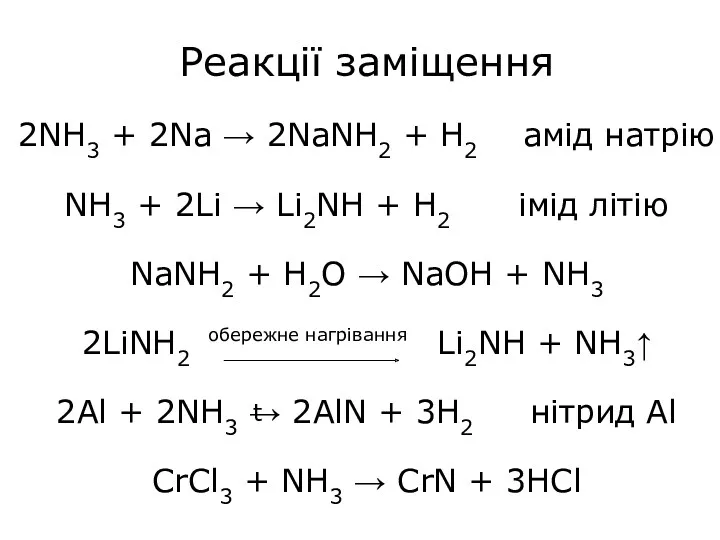
- 21. Реакції заміщення 2NH3 + 2Na → 2NaNH2 + H2 амід натрію NH3 + 2Li → Li2NH
- 22. NH3 ∙ HCl + Cl2 → NH2Cl + 2HCl NH2Cl + H2O → NH3 + HOCl
- 23. NH3 не є окисником, а відновні властивості проявляє слабо 4NH3 + 3O2 → 2N2 + 6H2O
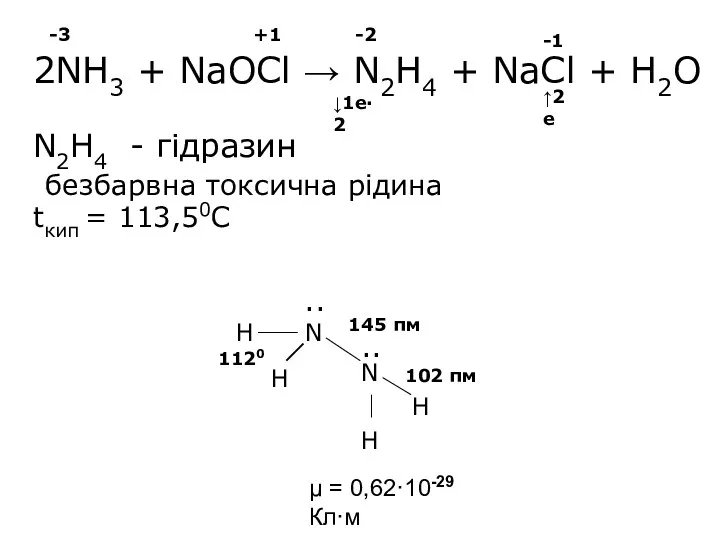
- 24. 2NH3 + NaOCl → N2H4 + NaCl + H2O N2H4 - гідразин безбарвна токсична рідина tкип
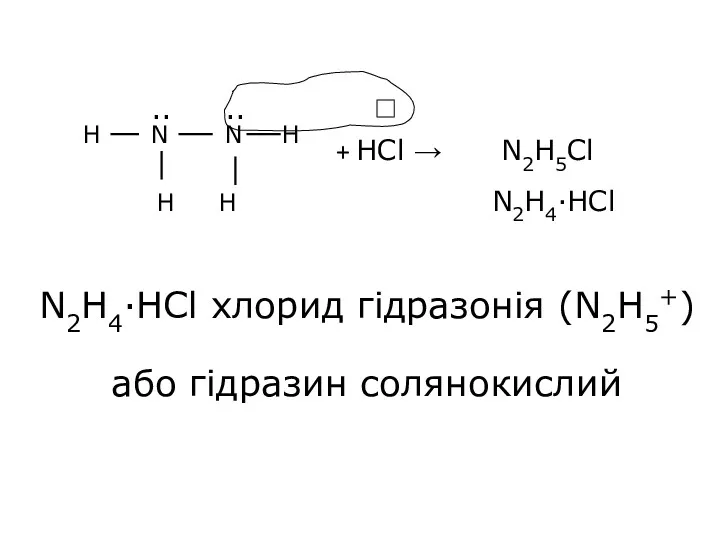
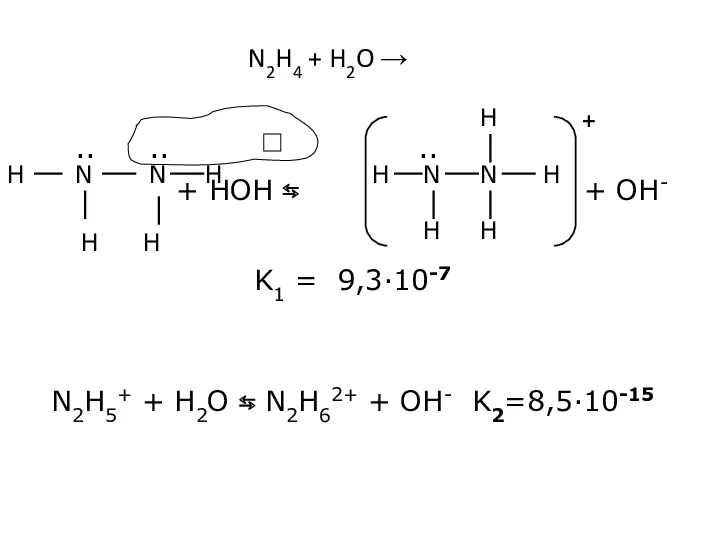
- 25. + HCl → N2H5Cl N2H4·HCl хлорид гідразонія (N2H5+) або гідразин солянокислий N2H4·HCl
- 26. + HOH ⇆ + OH- K1 = 9,3·10-7 N2H5+ + H2O ⇆ N2H62+ + OH- K2=8,5·10-15
- 27. Зв'язок N-N нестійкий тому N2H4 дуже легко реагує з різними окисниками Відновні властивості виражені сильніше ніж
- 28. N2 + 5H+ + 4e ⇆ N2H5+ E0 = -0,23 B N2 + 4H2O + 4e
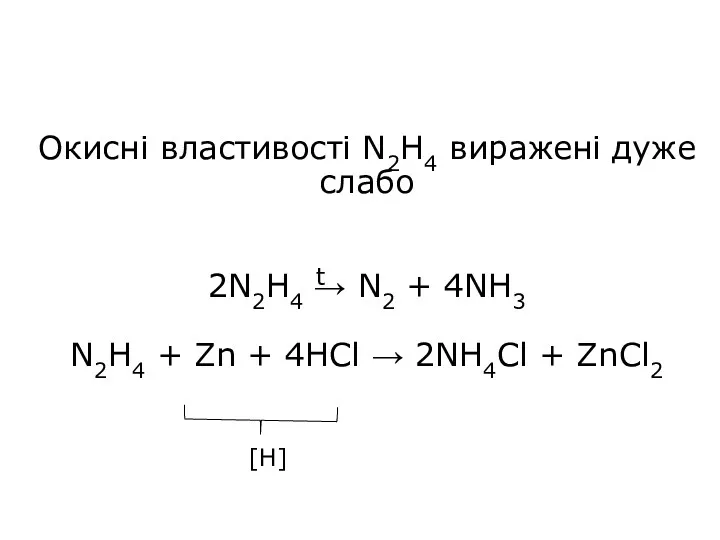
- 29. Окисні властивості N2H4 виражені дуже слабо 2N2H4 → N2 + 4NH3 N2H4 + Zn + 4HCl
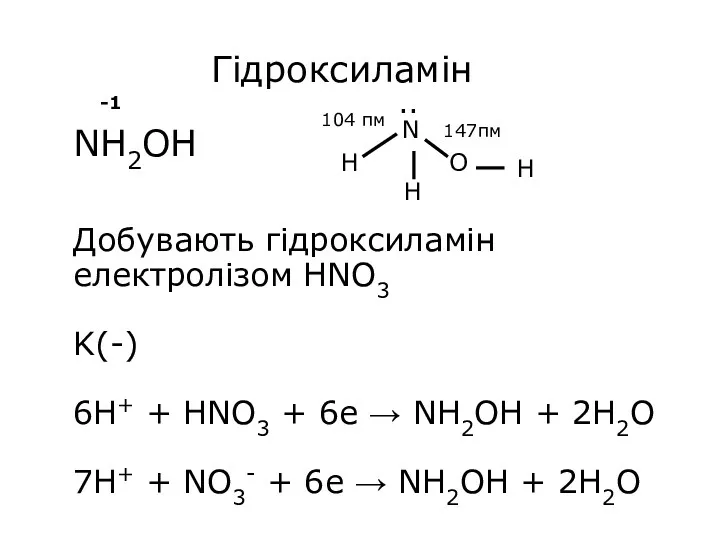
- 30. Гідроксиламін NH2OH Добувають гідроксиламін електролізом HNO3 K(-) 6H+ + HNO3 + 6e → NH2OH + 2H2O
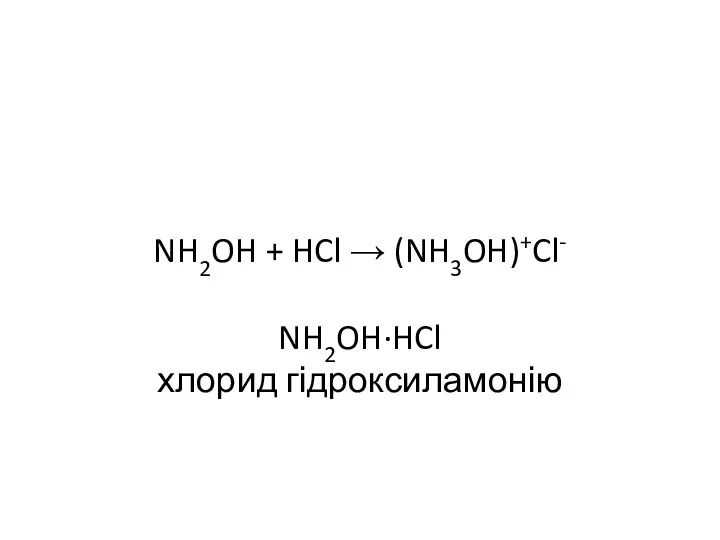
- 31. NH2OH + HCl → (NH3OH)+Cl- NH2OH·HCl хлорид гідроксиламонію
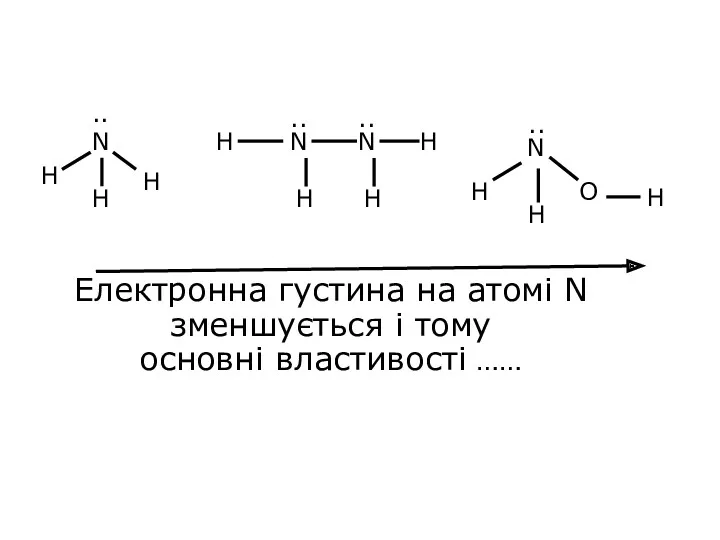
- 32. Електронна густина на атомі N зменшується і тому основні властивості ……
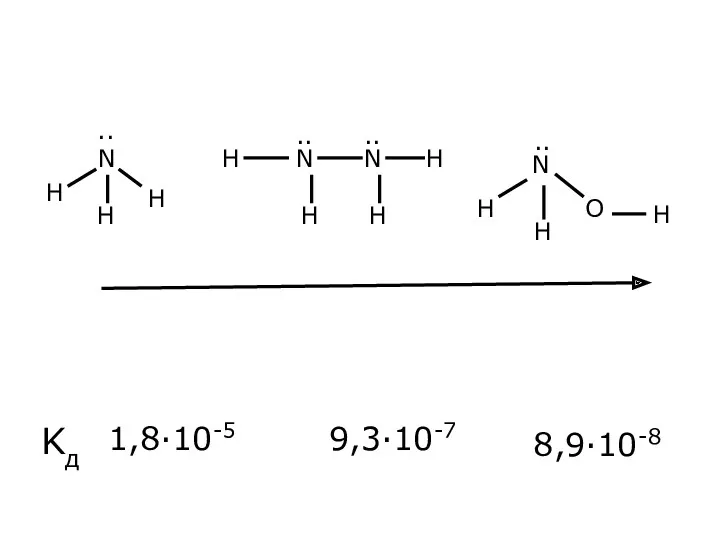
- 33. Kд 1,8·10-5 9,3·10-7 8,9·10-8
- 34. NH2OH може проявляти як відновні N2O + 5H2O + 4e ⇆ 2NH2OH + 4OH- E0 =
- 35. 10NH2OH + 2KMnO4 + 3H2SO4 → → 5N2 + 2MnSO4+ K2SO4 + 18H2O 10NH2OH + 4KMnO4
- 36. NH2OH + H2SO3 → H2SO4 + NH3 NH2OH + H2SO3 → NH4HSO4 4FeSO4 + 2 NH2OH
- 37. HN3 – азотистоводнева кислота (азидна кислота) Добування: N2H4 + HNO2 → HN3 + 2H2O (малий вихід)
- 38. [ N- = N+ = N- ] - Будова N3- подібна до будови молекули CO2
- 39. HN3 - безбарвна летка рідина tпл = -800С tкип = 370С У безводному вигляді – нестійка,
- 41. Скачать презентацию






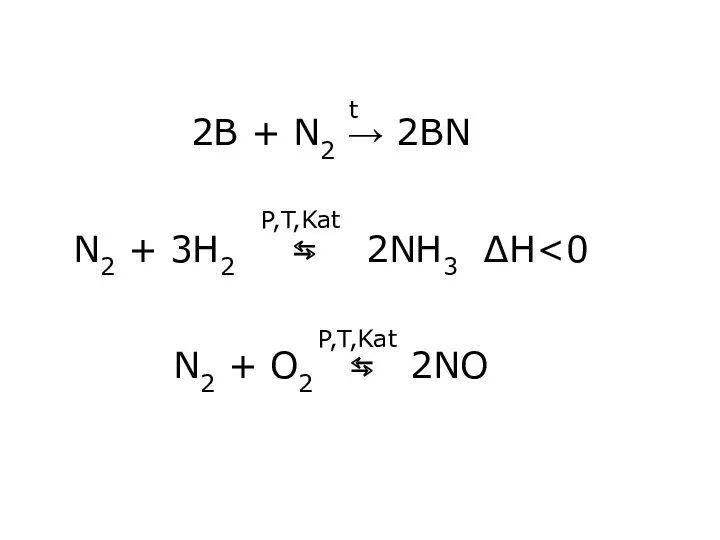

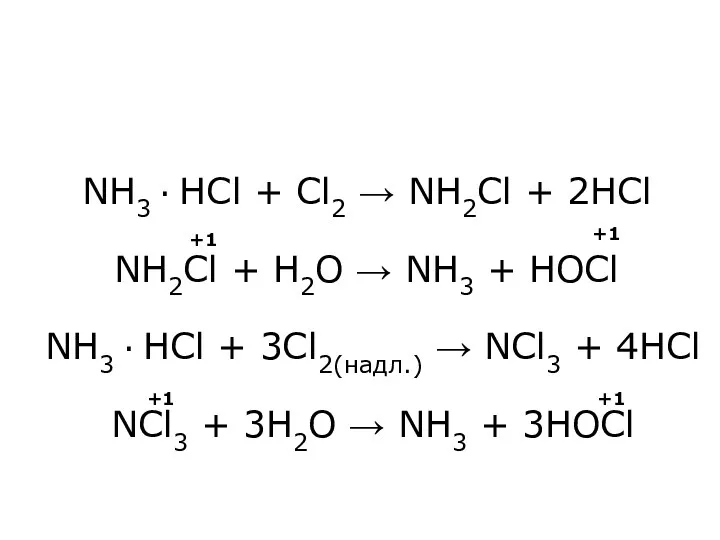


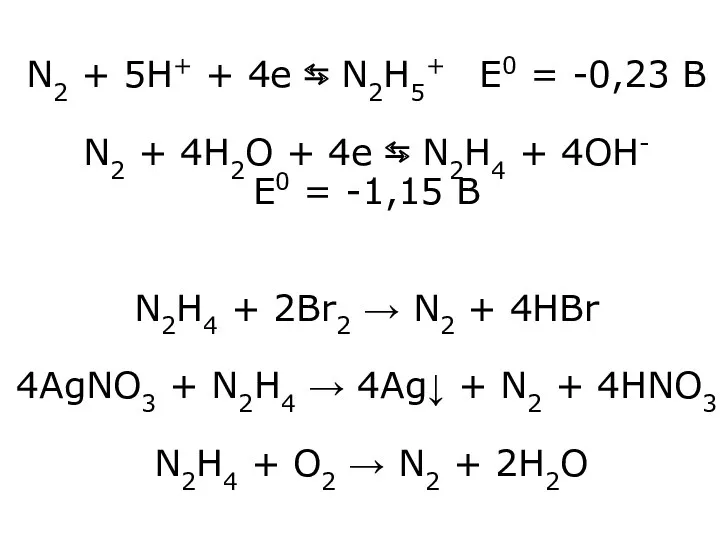

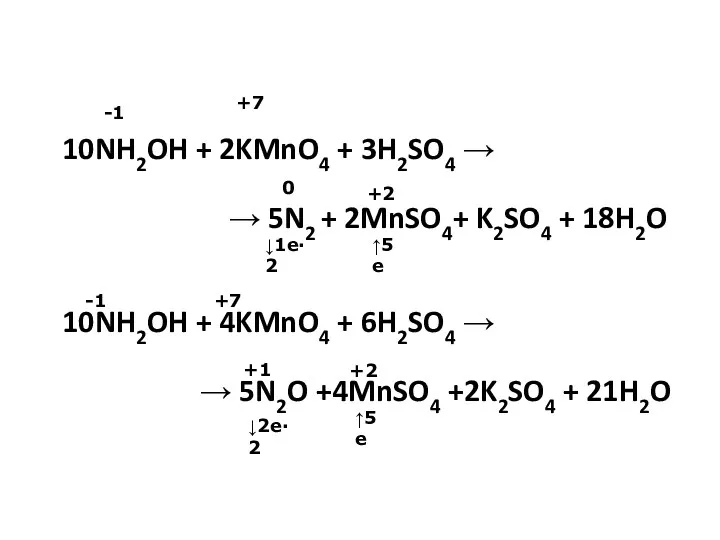
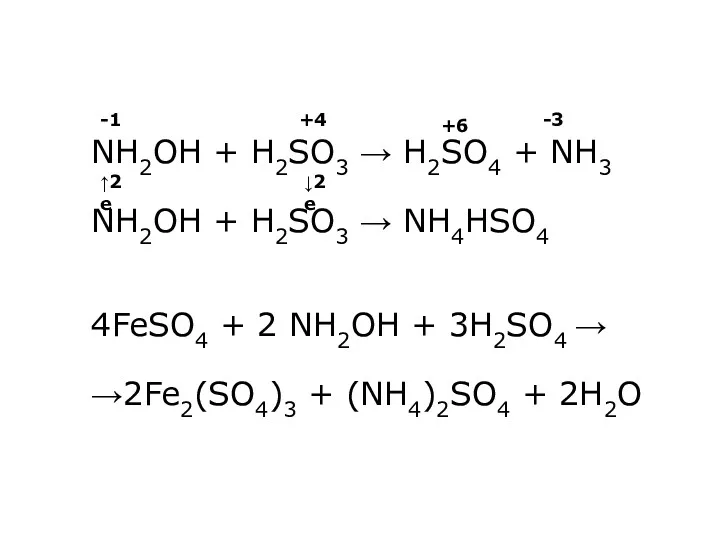

![[ N- = N+ = N- ] - Будова N3- подібна до будови молекули CO2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/580795/slide-37.jpg)

 Природные источники углеводородов
Природные источники углеводородов СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ
СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ Алкадиены
Алкадиены Квантовые числа
Квантовые числа Класифікація та властивості оксидів
Класифікація та властивості оксидів Положение в ПСХЭ водорода, лантаноидов, актиноидов и искусственно полученных элементов
Положение в ПСХЭ водорода, лантаноидов, актиноидов и искусственно полученных элементов Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Основы химической термодинамики
Основы химической термодинамики 20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii
20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii Қаныққан бір атомды спитртер
Қаныққан бір атомды спитртер Спирты, фенолы, тиолы
Спирты, фенолы, тиолы Көмірсулар Қайталау сабағы
Көмірсулар Қайталау сабағы Вольфрам — химический элемент
Вольфрам — химический элемент Золото
Золото Анализ качества лекарственных веществ, определяемых методом комплексонометрии
Анализ качества лекарственных веществ, определяемых методом комплексонометрии Хімічна кінетика
Хімічна кінетика Задания С 3 для подготовки к ГИА -9 по химии
Задания С 3 для подготовки к ГИА -9 по химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Закономерность изменений в строении электронных оболочек атома
Закономерность изменений в строении электронных оболочек атома Химическая промышленность России входит в авангардную тройку
Химическая промышленность России входит в авангардную тройку Физические и химические свойства алмаза. Алмазная промышленность в России
Физические и химические свойства алмаза. Алмазная промышленность в России Литология. Кремнистые породы
Литология. Кремнистые породы ЕГЭ Химия. Задание №5
ЕГЭ Химия. Задание №5 Химические свойства металлов
Химические свойства металлов Посуда, ее виды и использование
Посуда, ее виды и использование Неметаллические материалы
Неметаллические материалы Полиэтилен - термопластичный полимер этилена
Полиэтилен - термопластичный полимер этилена Основы коррозии и защиты металлов. Химическая коррозия
Основы коррозии и защиты металлов. Химическая коррозия