Содержание
- 2. Продуктивність апаратури, що використовується в хімічній промисловості, насамперед залежить від швидкості перебігу хімічних процесів. Кожний акт
- 3. Хімічні реакції можуть відбуватися в гомогенних (складаються з однієї фази) і в гетерогенних (складаються з двох
- 4. Кінетика реакцій у гомогенних системах Гомогенна реакція відбувається в усьому об´ємі системи.
- 5. Швидкість гомогенної реакції визначається числом елементарних актів хімічного перетворення в одиниці об’єму за одиницю часу. Кількість
- 6. Під час реакції концентрації речовин постійно змінюються, змінюється і її швидкість. Тому найчастіше користуються поняттям миттєвої
- 7. Вплив концентрації реагуючих речовин на швидкість хімічної реакції
- 8. Закон діючих мас (Гульдберґ і Вааґе, норвезькі вчені, 1867р.): швидкість хімічної реакції прямо пропорційна добутку концентрацій
- 9. H2 + I2 = 2HI швидкість хімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин: V =
- 10. Константа швидкості k чисельно дорівнює швидкості реакції, коли концентрації речовин дорівнюють 1 моль/л; значення константи швидкості
- 11. Для реакції 2NO + O2 = 2NO2 NO + NO + O2 = 2NO2 швидкість хімічної
- 12. Кожній реакції відповідає свій математичний вираз закону діючих мас, який називають кінетичним рівнянням реакції. Показник ступеню
- 13. Для реакції NH4Cl(водн розч) + HNO2 (водн розч) → N2 + 2 H2О + 2 HCl
- 14. Число молекул, які беруть участь в елементарному акті реакції, називають її молекулярністю (визначається механізмом реакції). Здебільшого
- 15. Порядки збігаються з молекулярностями тільки для елементарних (одностадійних) реакцій. Реакція H2 + I2 → 2HI є
- 16. Вплив температури на швидкість хімічної реакції . Енергія активації.
- 17. За правилом Вант-Гоффа (голландський вчений,1884р.): з підвищенням температури to на 10 К швидкість гомогенної реакції збільшується
- 18. ↑ Т5 = Т4+10 К = Т1+40 К (ΔТ=40 К) → VT5 = VT4· γ =
- 19. Відомо, що молекули газів зазнають щосекунди величезної кількості зіткнень (у повітрі за н.у. близько 109), і
- 20. Будь-яка реакція - це процес перебудови хімічних зв´язків → у вихідних молекулах мають: послабитись і навіть
- 21. У реакції H2 з I2 від зіткнення молекул : починають видовжуватися зв´язки H—H та I—I; з’являтися
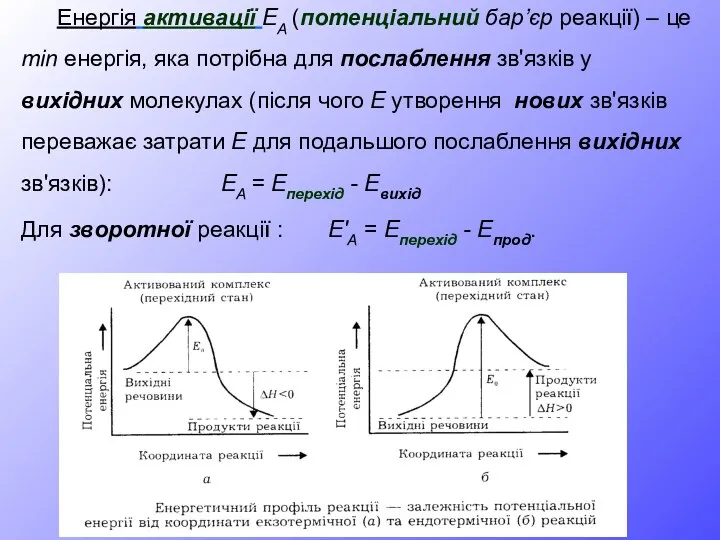
- 22. Енергія активації EA (потенціальний бар’єр реакції) – це min енергія, яка потрібна для послаблення зв'язків у
- 23. У хімічному перетворенні можуть брати участь тільки так звані активні молекули (Емолекули~ EA → активні молекули
- 24. Поняття про каталіз Як уже відомо, на швидкість реакції великий вплив має енергія активації. Чим нижчий
- 25. Нехай реакції A + B = AB відповідає ЕА. При введенні каталізатора К речовина А (або
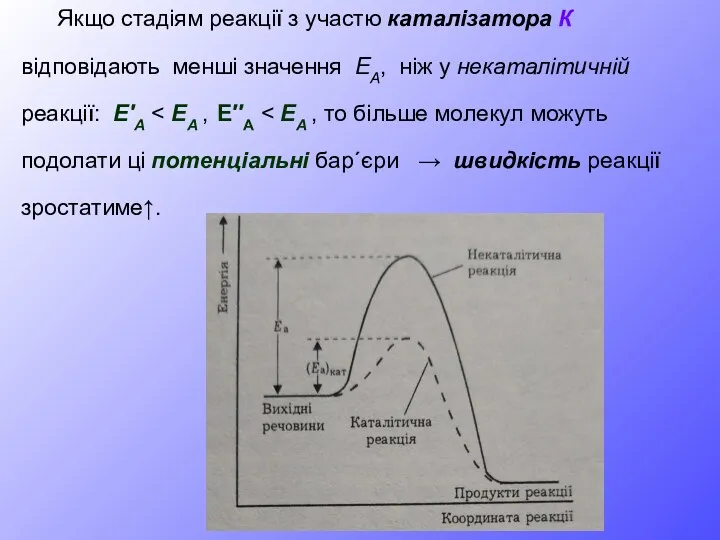
- 26. Якщо стадіям реакції з участю каталізатора К відповідають менші значення ЕА, ніж у некаталітичній реакції: Е′А
- 27. Гомогенний каталіз (каталізатор перебуває в тій самій фазі, що й реагуючі речовини): реакція: 2Н2O2 = 2H2O
- 28. Кінетика реакцій у гетерогенних системах
- 29. Гетерогенні реакції відбуваються на межі поділу фаз: горіння графіту: С(гр) + O2(г) = CO2(г) окиснення металів:
- 30. Швидкість гетерогенної реакції - число елементарних актів хімічної взаємодії, що відбуваються на одиниці поверхні за одиницю
- 31. Задача. Для реакції Н2 (г)+ I2 (г) → 2HI (г) розрахувати, у скільки разів збільшиться швидкість
- 33. Скачать презентацию



























 Металлы. Общая характеристика
Металлы. Общая характеристика Классификация минералов
Классификация минералов Набор № 3 ВС Щелочи
Набор № 3 ВС Щелочи 20230419_izomery
20230419_izomery Строение атома. Теории строения атома
Строение атома. Теории строения атома Адсорбция. Механизм адсорбции
Адсорбция. Механизм адсорбции Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие
Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие Изотопы. История открытия. Изотопы водорода
Изотопы. История открытия. Изотопы водорода Галогени. Хімічні властивості
Галогени. Хімічні властивості Научные основы и технологии зеленой химии
Научные основы и технологии зеленой химии Железо и его соединения
Железо и его соединения Основні принципи мас-спектрометрії
Основні принципи мас-спектрометрії Современные проблемы молекулярной биологии
Современные проблемы молекулярной биологии Висмут, ртуть, сурьма
Висмут, ртуть, сурьма Крахмал. Физические свойства
Крахмал. Физические свойства Вугдеводи. Моносахариди
Вугдеводи. Моносахариди Теории кислот и оснований. Буферные системы крови
Теории кислот и оснований. Буферные системы крови Cкорость химической реакции
Cкорость химической реакции Роль хімії в пізнанні природи
Роль хімії в пізнанні природи Ознайомлення зі зразками пластмас. Практична робота №4
Ознайомлення зі зразками пластмас. Практична робота №4 Приборы и методы исследования в химической технологии
Приборы и методы исследования в химической технологии Азотная кислота
Азотная кислота Взаємодія кисню зі складними та простими речовинами. Урок 31. 7 клас
Взаємодія кисню зі складними та простими речовинами. Урок 31. 7 клас Многоатомные спирты
Многоатомные спирты Кислород и озон
Кислород и озон Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Қазақстанда химияны оқыту әдістемесінің даму тарихы
Қазақстанда химияны оқыту әдістемесінің даму тарихы Химическое вещество
Химическое вещество