Содержание
- 2. Сегодня с вами мы говорим О том, чем дышим мы, А он невидим. Но разве можно
- 3. Из истории открытия 1772г.- К. Шееле шведский химик. 1774г.-Дж. Пристли английский химик. Дал ему название французский
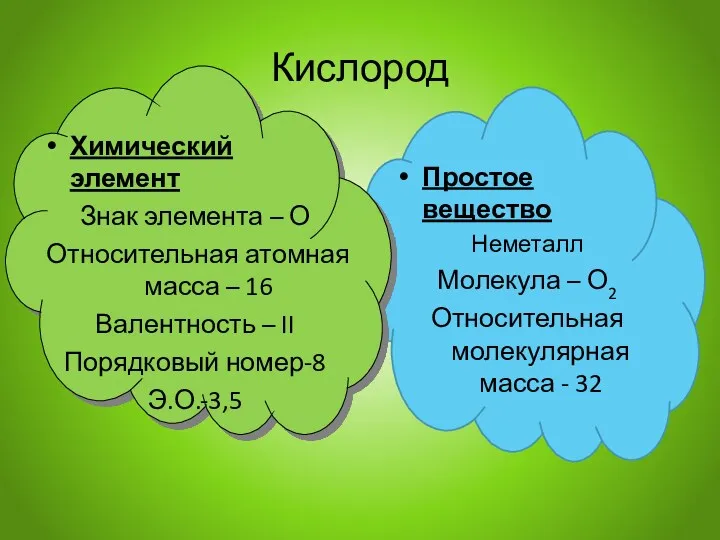
- 4. Кислород Химический элемент Знак элемента – О Относительная атомная масса – 16 Валентность – II Порядковый
- 5. Кислород как элемент 1. Элемент кислород находится в VI группе, главной подгруппе, II периоде, порядковый номер
- 6. Кислород в природе представлен 3-мя нуклидами(изотопами): 16О, 17О, 18О Вывод: атомы отличаются по числу содержащихся в
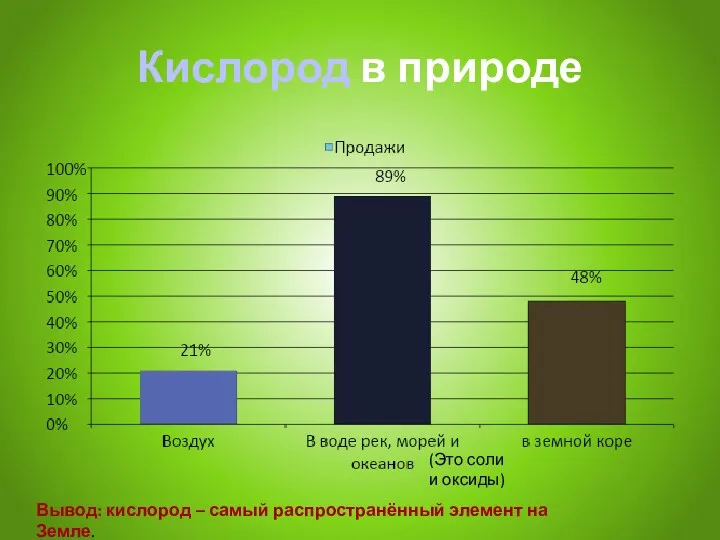
- 7. Кислород в природе (Это соли и оксиды) Вывод: кислород – самый распространённый элемент на Земле.
- 8. Лабораторные способы получения кислорода Кислород можно получить разложением перманганата калия 2KMnO4 = K2MnO4 + MnO2 +
- 9. Лабораторные способы получения кислорода разложение хлората калия 2KClO3 = 2KCl + 3O2 разложение перекиси водорода 2H2O2
- 10. Вывод: В лаборатории кислород получают …………. …………………………. веществ и собирают методом вытеснения ……………. . Разложением кислородсодержащих
- 11. Способы собирания вытеснение воды вытеснение воздуха =
- 12. Промышленный способ получения кислорода В промышленности кислород получают из воздуха: ректификация (разделение основано на разных температурах
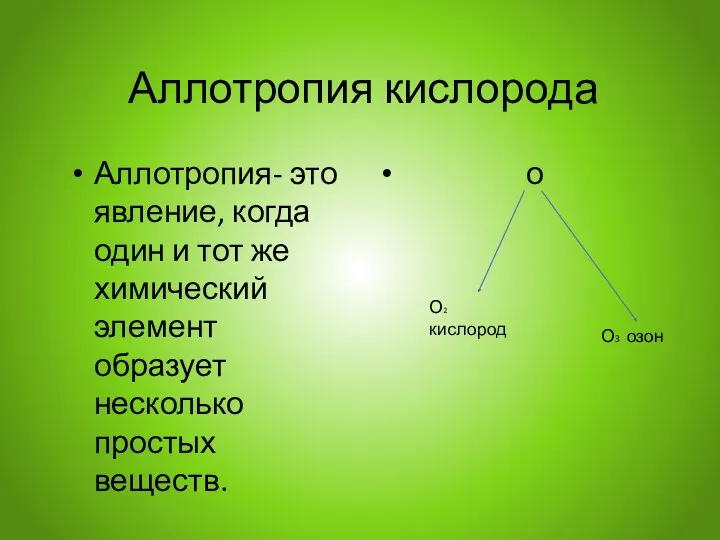
- 13. Аллотропия кислорода Аллотропия- это явление, когда один и тот же химический элемент образует несколько простых веществ.
- 14. Фотосинтез Почему, несмотря на расходование огромных количеств кислорода, его общее содержание в воздухе заметно не меняется?
- 15. В природе: Под воздействием солнечного излучения или электрического разряда Окисление смолы хвойных деревьев В лаборатории: В
- 16. Озон в природе Содержание озона в воздухе: Летом- до 7*10-9% (по объему), зимой- до 2*10-10% В
- 17. Физические свойства модификаций кислорода
- 18. Химические свойства кислорода В молекуле О2 химическая связь прочная, поэтому кислород при обычных условиях сравнительно малоактивен.
- 19. При нагревании реагирует с большинством простых веществ, кроме инертных газов и благородных металлов. S + O2
- 20. Каковы условия протекания данной реакции, если кислород находящийся в атмосфере весь не расходуется? N2 + O2
- 21. Химические свойства озона Озон неустойчив О3 = О2 + О О3 более сильный окислитель, чем кислород
- 22. Воздействие озона на организм человека Несколько микрограмм озона в литре воздуха – раздражение дыхательных путей, головокружение,
- 23. Найдите путь, который приведет вас к финишу. Для полного усвоения сведений, приведенных в лабиринте, выбирайте в
- 24. Выход из лабиринта
- 25. Домашнее задание: п. 20 , задание 1,3-5; п.21 задание 1,2. Литература: И.И. Новошинский, Н.С. Новошинская «Химия
- 27. Скачать презентацию



















 Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Соединения галогенов
Соединения галогенов Изомеризация пентан-гексановой фракции
Изомеризация пентан-гексановой фракции Металлы II группы главной подгруппы
Металлы II группы главной подгруппы Элементы триады железа: Fe, Co, Ni. (Лекция 16)
Элементы триады железа: Fe, Co, Ni. (Лекция 16) Водород H2
Водород H2 Жиры
Жиры Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник
Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник Функциональные производные углеводородов. Галогенопроизводные углеводородов
Функциональные производные углеводородов. Галогенопроизводные углеводородов Пластмассы. Связующие вещества
Пластмассы. Связующие вещества Химическая связь и ее типы. Кристаллические решетки
Химическая связь и ее типы. Кристаллические решетки Лабораторное оборудование, посуда и средства защиты. Химическая лаборатория
Лабораторное оборудование, посуда и средства защиты. Химическая лаборатория Металлы. Определения. Положение в периодической системе. Металлы в алхимии
Металлы. Определения. Положение в периодической системе. Металлы в алхимии Осмий. Применение
Осмий. Применение General, specific properties are common to all matters
General, specific properties are common to all matters Кислоты в свете теории электролитической диссоциации (ТЭД), 8 класс
Кислоты в свете теории электролитической диссоциации (ТЭД), 8 класс Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды Висбрекинг (перспективный процесс ТК)
Висбрекинг (перспективный процесс ТК) Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Химические реакции
Химические реакции Классы неорганических веществ
Классы неорганических веществ Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Массовая доля элемента в веществе
Массовая доля элемента в веществе Алкины. Понятие алкинов. Формула алкинов
Алкины. Понятие алкинов. Формула алкинов Вуглеводи. Лекція
Вуглеводи. Лекція Дисперсные системы. 11 класс
Дисперсные системы. 11 класс Дисахариды, моносахариды
Дисахариды, моносахариды Электролитическая диссоциация
Электролитическая диссоциация