Содержание
- 2. Повторяем Вставьте пропущенные слова в предложения: Галогены – это элементы … группы, … подгруппы. В атомах
- 3. Галогеноводороды Общая формула – НГ Физические свойства: Газы, Ц , резкий запах. Хорошо растворимы в воде.
- 4. «Растворение хлороводорода в воде» http://www.youtube.com/watch?v=_pPDa-1bKBY ! При растворении хлороводорода в воде образуется соляная кислота.
- 5. Галогеноводородные кислоты Водным растворам галогеноводородов присущи все свойства кислот. HF – HCl – HBr – HI
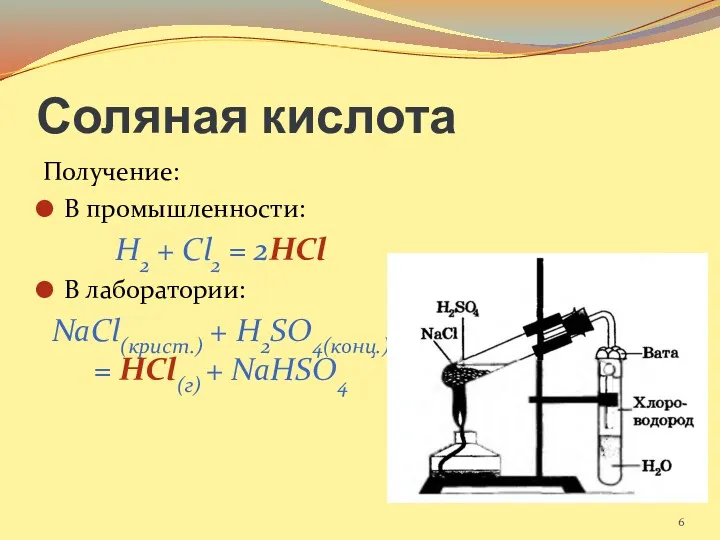
- 6. Соляная кислота Получение: В промышленности: H2 + Cl2 = 2HCl В лаборатории: NaCl(крист.) + H2SO4(конц.) =
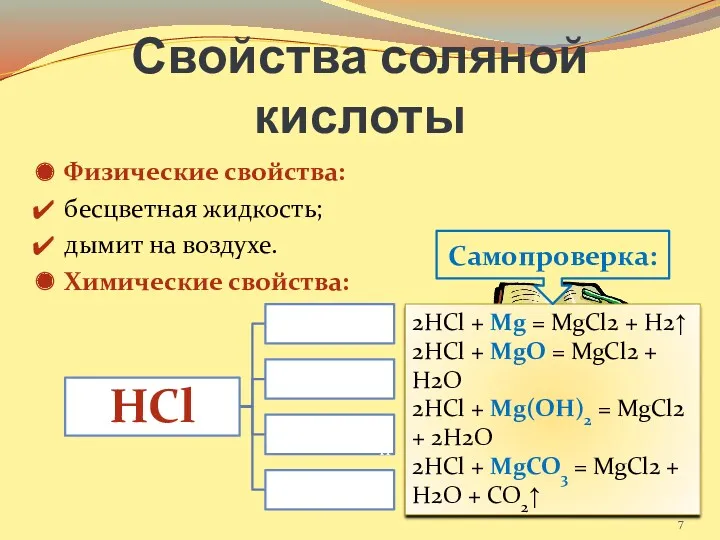
- 7. Свойства соляной кислоты Физические свойства: бесцветная жидкость; дымит на воздухе. Химические свойства: Задание: составьте соответствующие уравнения
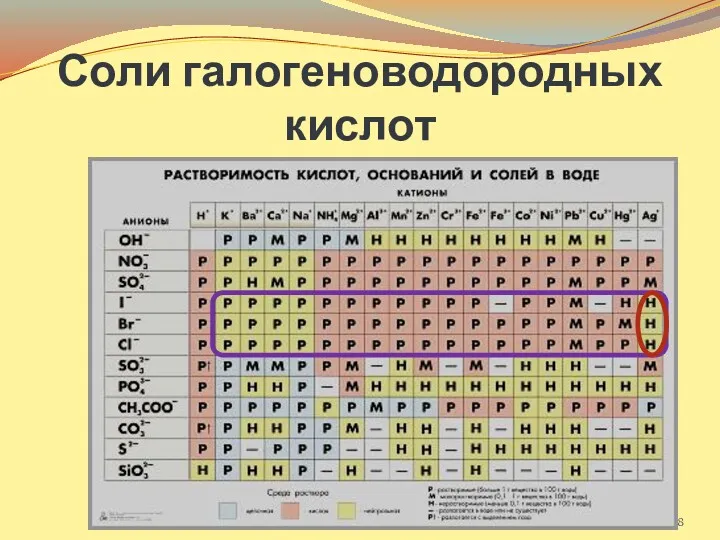
- 8. Соли галогеноводородных кислот
- 9. Качественные реакции на хлорид-, бромид- и иодид-ионы Галогенид-ионы можно определить с помощью нитрата серебра AgNO3. Осадок
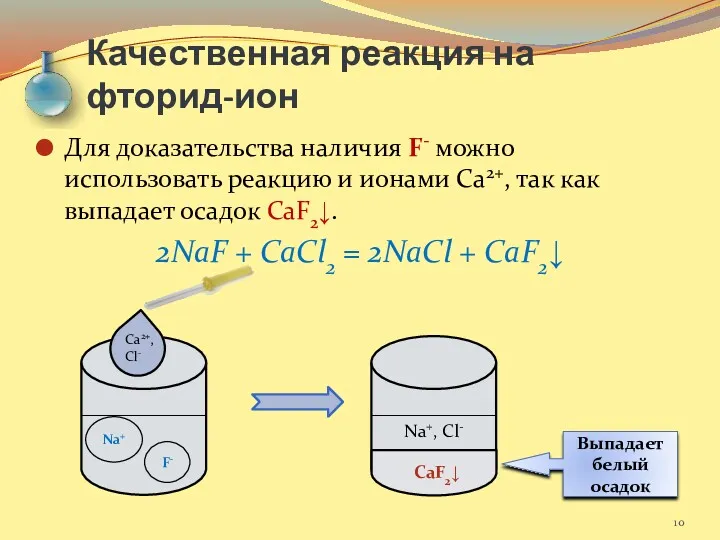
- 10. Качественная реакция на фторид-ион Для доказательства наличия F- можно использовать реакцию и ионами Са2+, так как
- 12. Скачать презентацию





 Алюміній і сполуки алюмінію у побуті людини
Алюміній і сполуки алюмінію у побуті людини Химический эквивалент. Значение растворов в жизнедеятельности организмов. Способы выражения состава растворов
Химический эквивалент. Значение растворов в жизнедеятельности организмов. Способы выражения состава растворов Количество вещества. 8 класс
Количество вещества. 8 класс Методы химии
Методы химии Атмосфера. Химия стратосферы
Атмосфера. Химия стратосферы Хімія запаху і смаку
Хімія запаху і смаку Технологии повышения конструкционной прочности сталей
Технологии повышения конструкционной прочности сталей Искусственные и трансурановые элементы
Искусственные и трансурановые элементы Роль хімії у житті суспільства
Роль хімії у житті суспільства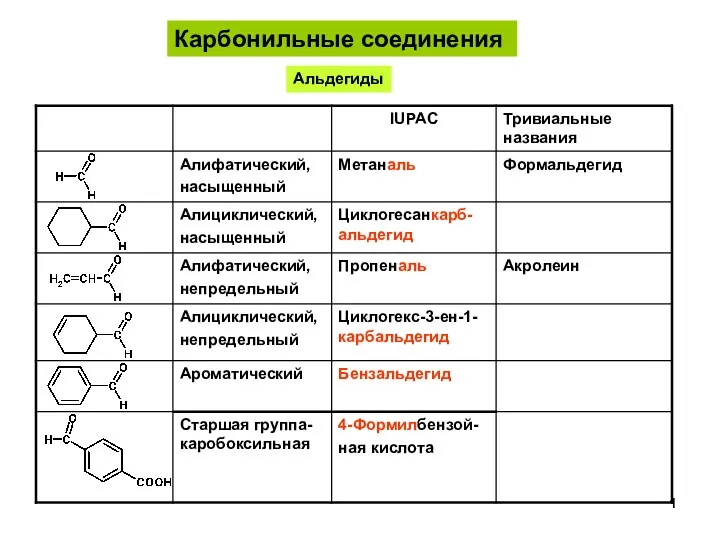 АльдегидыКетоны-1
АльдегидыКетоны-1 Значення хімічних процесів у природі
Значення хімічних процесів у природі Полиэтилен
Полиэтилен Распространение водорода в природе. Получение в лаболатории
Распространение водорода в природе. Получение в лаболатории Фізичні властивості та хімічний склад природних вод
Фізичні властивості та хімічний склад природних вод Метаморфические породы
Метаморфические породы ПВХ
ПВХ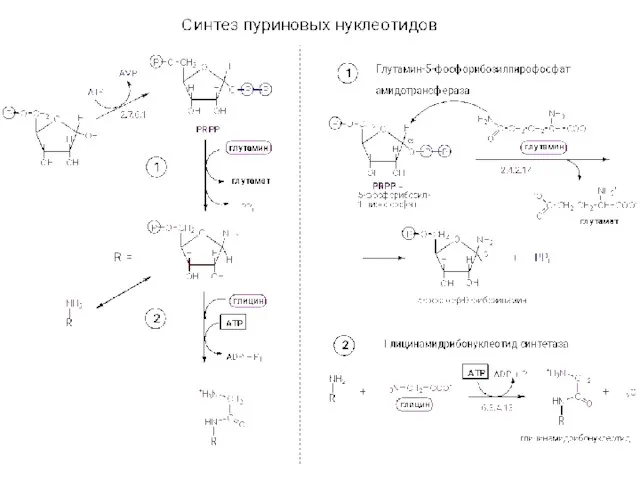 Синтез нуклеотидов
Синтез нуклеотидов Разделение углеводородных газов
Разделение углеводородных газов Классификация и свойства оксидов
Классификация и свойства оксидов Общие сведения об электрорадиоматериалах
Общие сведения об электрорадиоматериалах Основні властивості металів. Хімія металургійних процесів. Теорія сплавів. Корозія металів
Основні властивості металів. Хімія металургійних процесів. Теорія сплавів. Корозія металів Синтез супрамолекулярных структур
Синтез супрамолекулярных структур Общая характеристика элементов V группы главной подгруппы
Общая характеристика элементов V группы главной подгруппы Гониометрическое исследование кристаллов
Гониометрическое исследование кристаллов Углепластики
Углепластики Удобрения
Удобрения Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник
Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник Циклоалканы. Строение циклоалканов
Циклоалканы. Строение циклоалканов