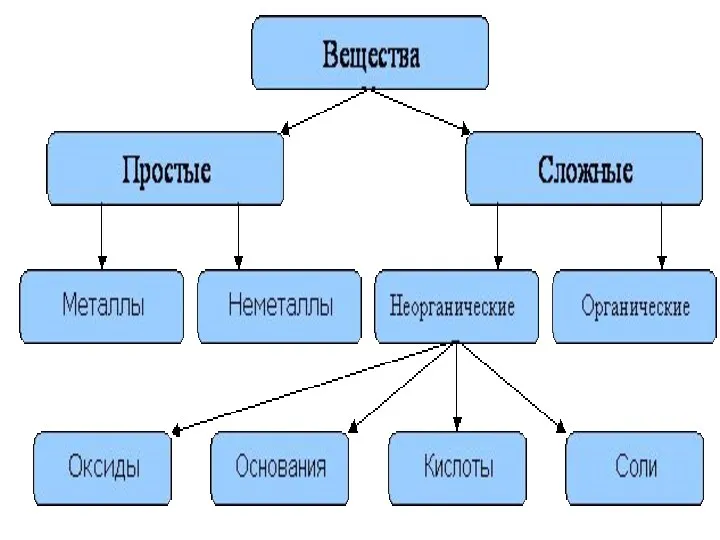
Содержание
- 3. Оксиды соединения, образованные атомами двух элементов, одним из которых является кислород в степени окисления (– 2)
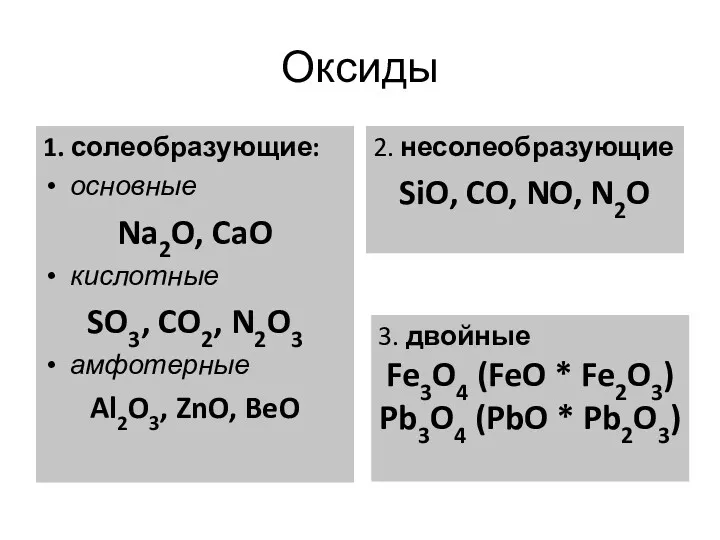
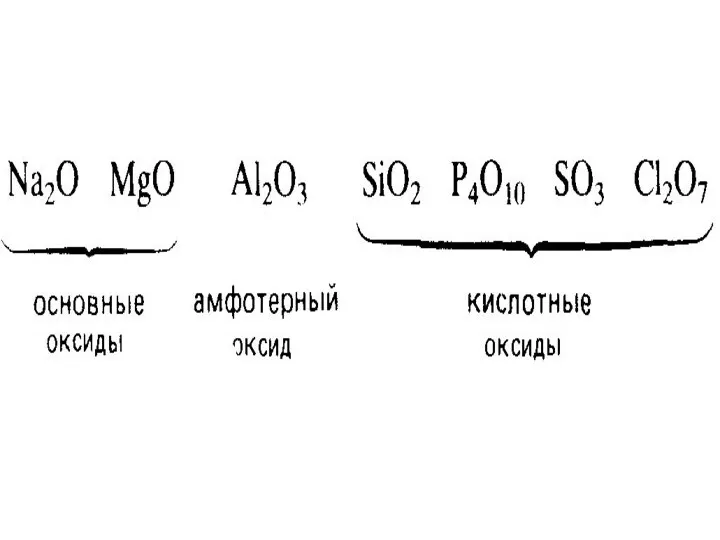
- 4. Оксиды 1. солеобразующие: основные Na2O, CaO кислотные SO3, CO2, N2O3 амфотерные Al2O3, ZnO, BeO 2. несолеобразующие
- 6. Основные оксиды – оксиды всех металлов главной подгруппы первой группы (щелочные металлы Li – Fr) –
- 7. Оксид железа (III)
- 8. Оксид алюминия
- 9. Оксид хрома (III)
- 10. Оксид кальция
- 11. Оксид железа (II)
- 12. Оксид ртути (II)
- 13. Оксид магния
- 14. Оксид свинца (II)
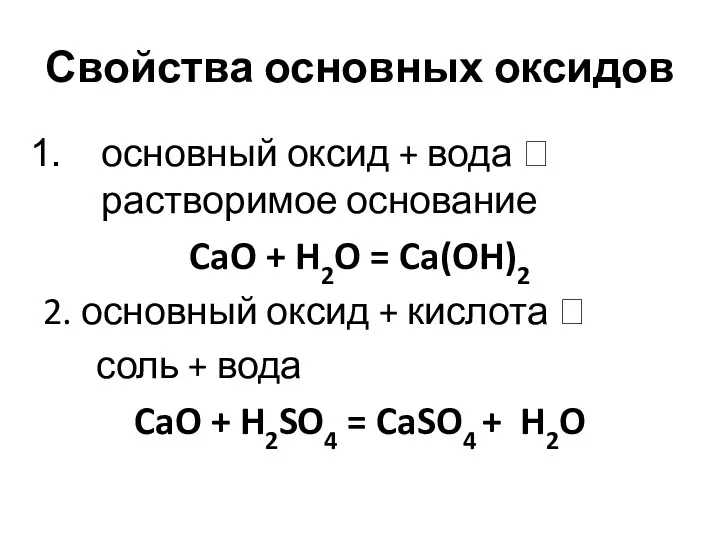
- 15. Свойства основных оксидов основный оксид + вода ? растворимое основание CaO + H2O = Ca(OH)2 2.
- 16. Свойства основных оксидов 3. основный оксид + кислотный оксид ? соль CaO + CO2= CaCO3 4.
- 17. Кислотные оксиды оксиды металлов со степенью окисления от +4 до +7 оксиды неметаллов (искл. несолеообразующие)
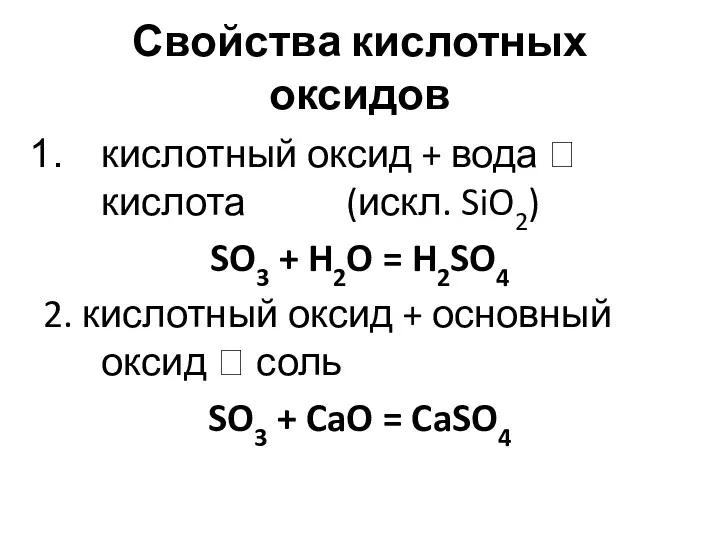
- 18. Свойства кислотных оксидов кислотный оксид + вода ? кислота (искл. SiO2) SO3 + H2O = H2SO4
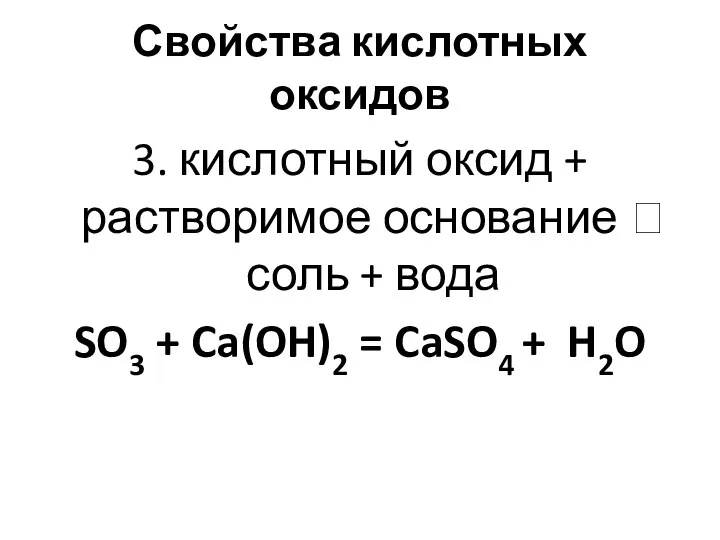
- 19. Свойства кислотных оксидов 3. кислотный оксид + растворимое основание ? соль + вода SO3 + Ca(OH)2
- 20. Амфотерные оксиды оксиды, способные проявлять и кислотные и основные свойства реагируя с сильной кислотой или кислотным
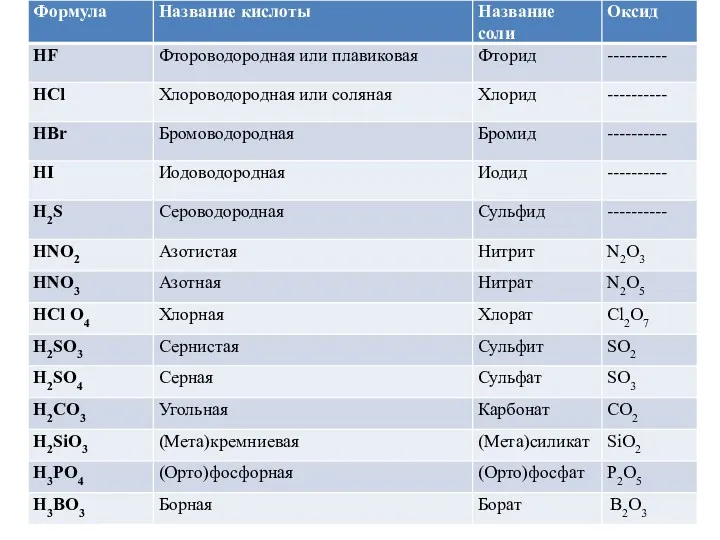
- 21. Кислоты- электролиты, при диссоциации которых образуется катион водорода и анион кислотного остатка Классификация: 1. неорганические HNO3
- 22. Классификация кислот 2. по содержанию кислорода: бескислородные HCl кислородсодержащие H2SO4 3. по содержанию водорода (основности): одноосновные
- 23. Серная кислота
- 24. Хлороводородная кислота
- 25. Азотная кислота
- 26. Борная кислота
- 27. Ацетилсалициловая кислота
- 28. Уксусная кислота
- 29. Салициловая кислота
- 30. Муравьиная кислота
- 31. Яблочная кислота
- 32. Щавелевая кислота
- 33. Молочная кислота
- 34. Лимонная кислота
- 35. Витамин С
- 36. Пальмитиновая кислота
- 37. Винная кислота
- 38. Хлороводородная кислота
- 39. Хлороводородная кислота
- 40. Хлороводородная кислота
- 41. Хлороводородная кислота
- 43. Свойства кислот-неокислителей 1. кислота + металл ? соль + Н2↑ ( искл. металл в ряду активности
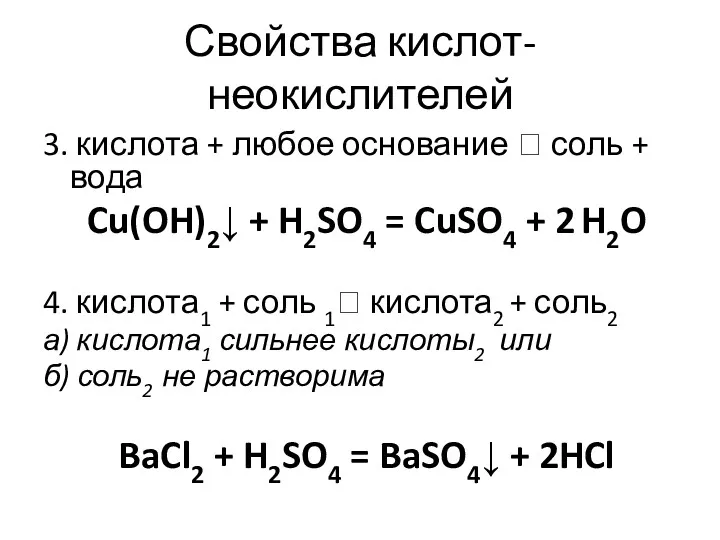
- 44. Свойства кислот-неокислителей 3. кислота + любое основание ? соль + вода Cu(OH)2↓ + H2SO4 = CuSO4
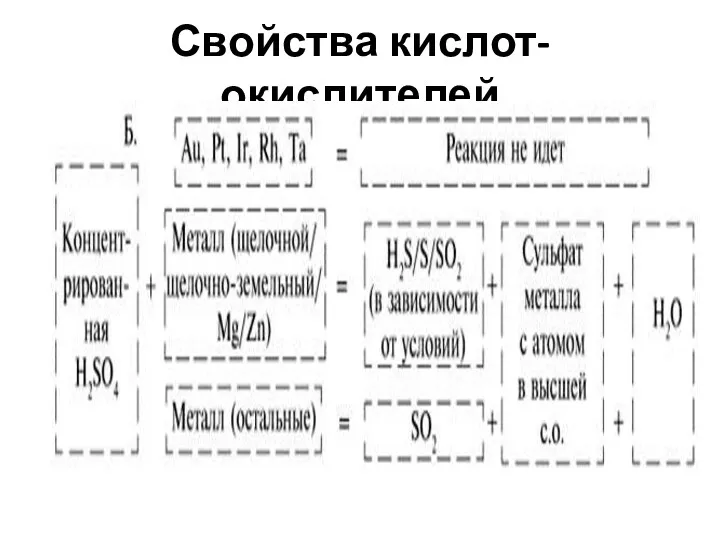
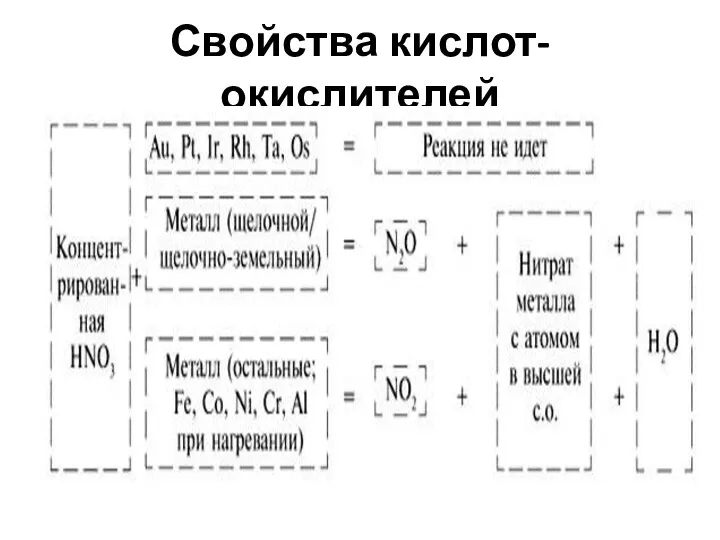
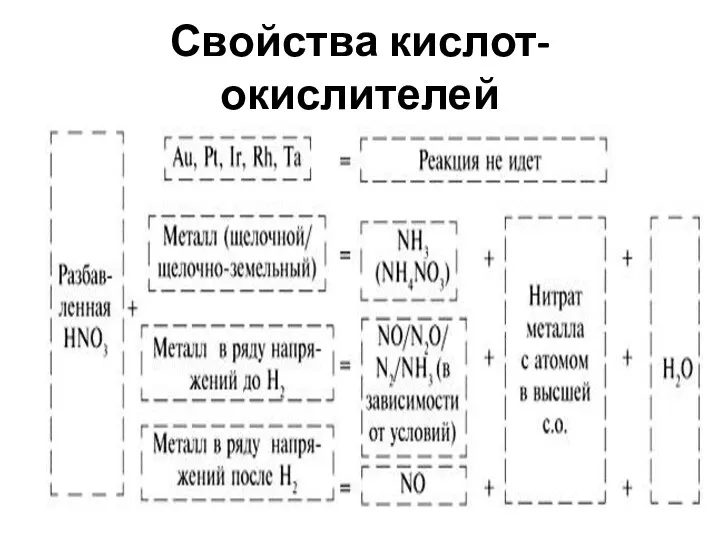
- 45. Свойства кислот-окислителей
- 46. Свойства кислот-окислителей
- 47. Свойства кислот-окислителей
- 48. Свойства кислот-окислителей Cu + 4 HNO3 (к)= Cu(NO3)2 + 2 NO2 + 2 H2O 3 Cu
- 49. Серная кислота
- 50. Азотная кислота
- 51. Серная кислота
- 52. Серная кислота
- 53. Серная кислота
- 54. Основания электролиты, при диссоциации которых образуется катион металла и анион гидроксогруппы номенклатура: «гидроксид» + какого металла?
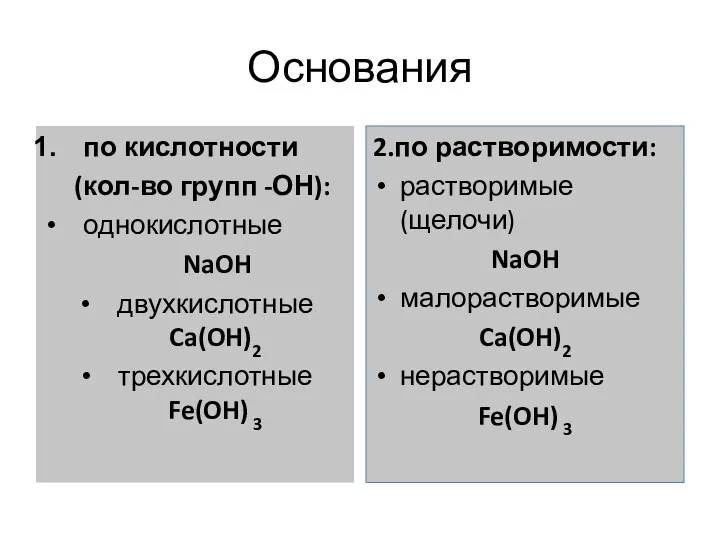
- 55. Основания по кислотности (кол-во групп -ОН): однокислотные NaOH двухкислотные Ca(OH)2 трехкислотные Fe(OH) 3 2.по растворимости: растворимые
- 56. Гидроксид натрия
- 57. Гидроксид натрия на воздухе
- 58. Гидроксид калия
- 59. Гидроксид калия на воздухе
- 60. Гидроксид натрия
- 61. Гидроксид натрия
- 62. Гидроксид натрия
- 63. Гидроксид калия
- 64. Гидроксид калия
- 65. Гидроксид калия
- 66. Гидроксид железа (III)
- 67. Гидроксид меди (II)
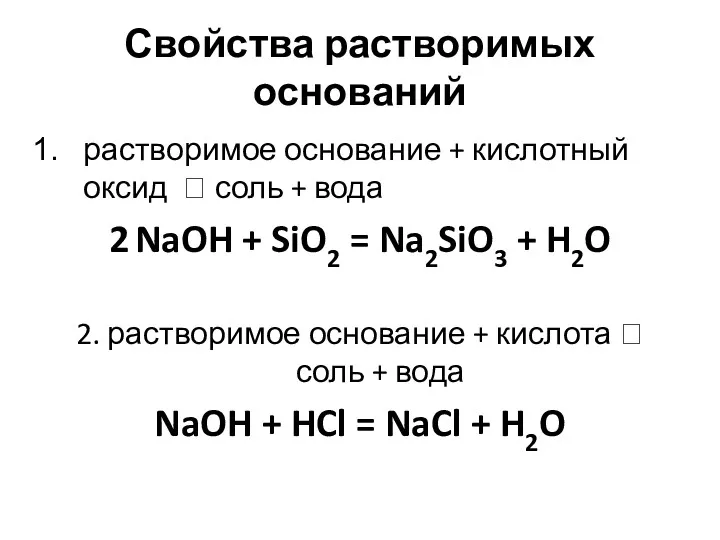
- 68. Свойства растворимых оснований растворимое основание + кислотный оксид ? соль + вода 2 NaOH + SiO2
- 69. Свойства растворимых оснований 2 NaOH + FeCl2 = Fe(OH)2↓ + 2 NaCl 3. растворимое основание +
- 70. Свойства нерастворимых оснований нерастворимое основание + кислота ? соль + вода Cu(OH)2 ↓+ H2SO4 = CuSO4
- 71. Соли электролиты, которые в водных растворах диссоциируют на катионы металлов и анионы кислотного остатка номенклатура: «кислотный
- 72. Соли средние Na2CO3 кислые NaHCO3 основные Al(OH)Cl2 двойные KAl(SO4)2 смешанные CaOCl2 комплексные K3[Fe(CN)6]
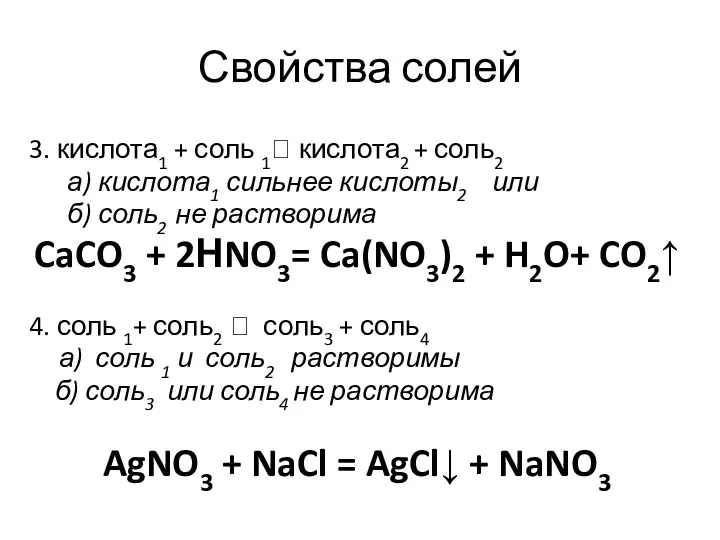
- 73. Свойства солей 1. металл1 + соль 1? металл2 + соль2 а) соль 1 растворима б) металл1
- 74. Свойства солей 3. кислота1 + соль 1? кислота2 + соль2 а) кислота1 сильнее кислоты2 или б)
- 75. Перманганат калия
- 76. Хлорид кальция
- 77. Хлорид меди(II)
- 78. Хлорид железа (III)
- 79. Хлорид меди(II)
- 80. Хлорид натрия (поваренная соль)
- 81. Хлорид калия
- 82. Хлорид никеля (II)
- 83. Хлорид магния
- 84. Хлорид кобальта (II)
- 85. Хлорид марганца (II)
- 86. Хлорид натрия
- 87. Хлорид натрия (поваренная соль)
- 88. Сульфат меди(II)
- 89. Сульфат никеля (II)
- 90. Сульфат меди(II)
- 91. Сульфат железа (II)
- 92. Сульфат меди(II)
- 93. Сульфат магния
- 94. Нитрат железа (III)
- 95. Нитрат калия
- 96. Нитрат кобальта (II)
- 97. Карбонат кальция
- 98. Карбонат кальция
- 99. Бихромат калия
- 100. Морская вода
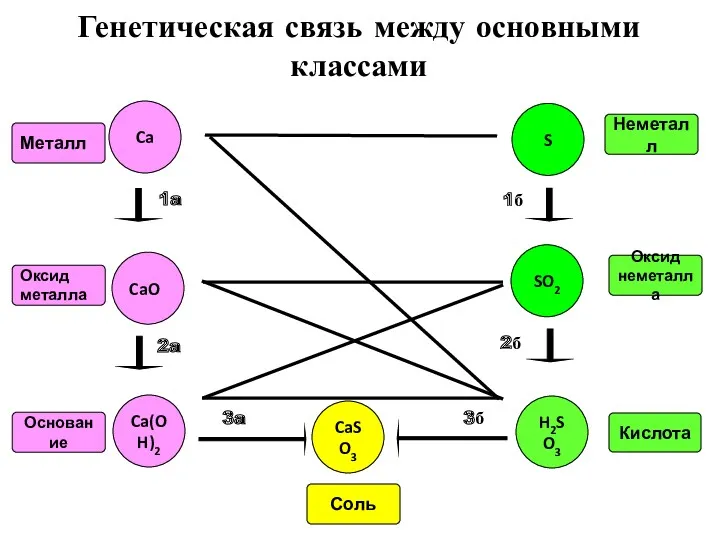
- 101. Генетическая связь между основными классами неорганических соединений основана на получении веществ одного класса из веществ другого
- 102. Оксид металла Металл Генетическая связь между основными классами S SO2 H2SO3 Ca CaO Ca(OH)2 CaSO3 1a
- 104. Скачать презентацию

























































![Соли средние Na2CO3 кислые NaHCO3 основные Al(OH)Cl2 двойные KAl(SO4)2 смешанные CaOCl2 комплексные K3[Fe(CN)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/295583/slide-71.jpg)




























 Легированные стали
Легированные стали Начала химической термодинамики
Начала химической термодинамики Одноатомные спирты
Одноатомные спирты Азотная кислота и ее соли. 9 класс
Азотная кислота и ее соли. 9 класс Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева
Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева Методы окислительно-восстановительного и комплексонометри-ческого титрования
Методы окислительно-восстановительного и комплексонометри-ческого титрования Виды присадок к моторным топливам
Виды присадок к моторным топливам Вещества и их превращения Роль химии в нашей жизни
Вещества и их превращения Роль химии в нашей жизни Вред Coca-Cola на организм человека
Вред Coca-Cola на организм человека Трансформация энергии в процессе оксигенного фотосинтеза
Трансформация энергии в процессе оксигенного фотосинтеза Железо строение и свойства
Железо строение и свойства Химический состав водоотталкивающих средств
Химический состав водоотталкивающих средств Будова електронних оболонок атомів
Будова електронних оболонок атомів Алканы. Углеводороды. Предельные (насыщенные, алканы)
Алканы. Углеводороды. Предельные (насыщенные, алканы) Методы выделения и очистки продуктов биотехнологических производств
Методы выделения и очистки продуктов биотехнологических производств Кальций и его соединения
Кальций и его соединения Строение атома и атомного ядра. Изотопы
Строение атома и атомного ядра. Изотопы Прикладная геохимия. Вторичные ореолы
Прикладная геохимия. Вторичные ореолы Предмет органической химии
Предмет органической химии Количество вещества. 8 класс
Количество вещества. 8 класс Иониты и цеолиты. Цеолитные катализаторы
Иониты и цеолиты. Цеолитные катализаторы Карбонильные соединения. Альдегиды
Карбонильные соединения. Альдегиды Процесс оксихлорирования
Процесс оксихлорирования Органічні речовини як основа сучасних матеріалів. Пластмаси, синтетичні каучуки, гума, штучні й синтетичні волокна
Органічні речовини як основа сучасних матеріалів. Пластмаси, синтетичні каучуки, гума, штучні й синтетичні волокна Технология лаков и красок
Технология лаков и красок Круговорот воды в природе
Круговорот воды в природе Соединения фосфора: оксид фосфора (V). Ортофосфорная кислота и ее соли
Соединения фосфора: оксид фосфора (V). Ортофосфорная кислота и ее соли Обмен нуклеотидов
Обмен нуклеотидов