Содержание
- 2. Електрон в атомі має місце, яке можна визначити. Електрон в атомі не має місця, яке можна
- 3. 2. Число енергетичних рівнів в атомі дорівнює номеру групи, в якій він розташований. Число енергетичних рівнів
- 4. 3. Максимально можлива кількість електронів на ІІ енергетичному рівні дорівнює 10. Максимально можлива кількість електронів на
- 5. 4. На І та ІІ енергетичних рівнях міститься однакова кількість електронів. На І та ІІ енергетичних
- 6. 5. Завершений рівень містить максимальну кількість електронних підрівнів (s, p, d, f) Завершений рівень містить максимальну
- 7. 6. В утворенні хімічного зв’язку приймають участь електрони зовнішнього енергетичного рівня. В утворенні хімічного зв’язку приймають
- 8. «Завдання на засипку» Знайдіть в таблиці Менделєєва елемент № 18. Вкажіть загальну кількість його електронів. Скільки
- 9. Тема. Будова електронних оболонок атомів елементів І – ІІІ періодів.
- 10. Мета уроку: закріпити поняття про стан електронів в атомі; розширити поняття енергетичних рівнів і підрівнів, спіну;
- 11. План: Розташування орбіталей у просторі. Спін електрону. Порядок заповнення рівнів та підрівнів електронами в атомі. Порядок
- 12. Розташування орбіталей у просторі. Наш світ трьохвимірний. Тому орбіталі розташовуються навколо ядра певним чином та мають
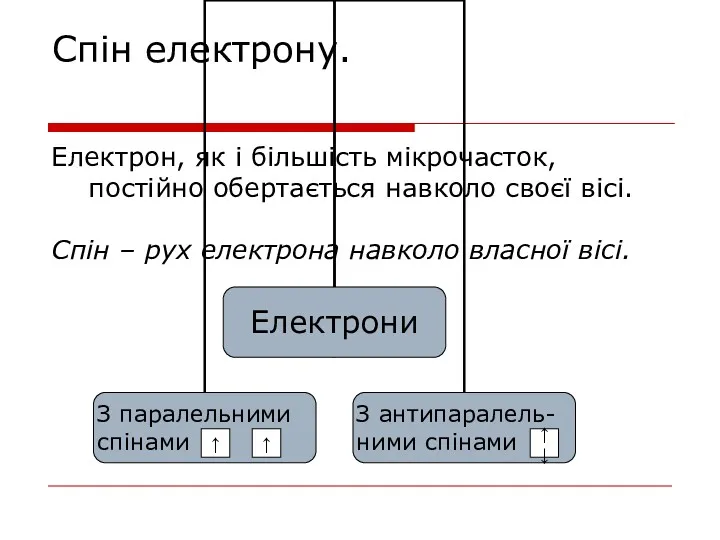
- 13. Спін електрону. Електрон, як і більшість мікрочасток, постійно обертається навколо своєї вісі. Спін – рух електрона
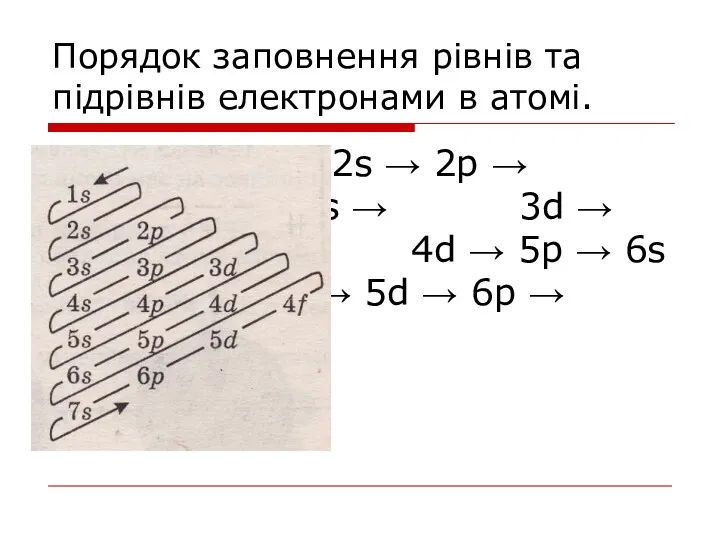
- 14. Порядок заповнення рівнів та підрівнів електронами в атомі. 1s → 2s → 2p → 3s →
- 15. Порядок складання електронної формули атомів. Визначаємо загальне число електронів (за порядковим номером елементу) Наприклад: флуор F
- 16. 2. Визначаємо кількість енергетичних рівнів. Флуор – в ІІ періоді, тому в нього 2 енергетичні рівні.
- 17. 3. Рівні розподіляють на підрівні та орбіталі (кількість підрівнів дорівнює номеру енергетичного рівня) F – 9
- 18. 4. Розподіляємо електрони по орбіталях, памятаючи, що одна орбіталь містить не більше двох електронів, і заповнюються
- 19. ↑↓ 5. Електрони на зовнішньому енергетичному рівні – це валентні електрони, що приймають участь в утворенні
- 20. 6. Всі елементи поділяються на s-, p-, d-, f-елементи, в залежності від того, який підрівень є
- 21. Завдання для груп: скласти електронну формулу з комірками хлору 1s22s22p33s23p53d0 3s2 3p5 3d0 2s2 2p6 1s2
- 22. Чому хлор може мати валентність VІІ, а флуор – тільки І? F: 2s2 2p5 Cl :
- 23. Атом може втратити або прийняти електрон. Як ви вважаєте, які наслідки для нього це буде мати?
- 24. Завдання групам Складіть електронні формули з комірками йонів (с.140-141) 1. Na+ 2s2 2p6 3s0 2.F- 2s2
- 25. Що спільного між всіми формулами? Йони приймають конфігурацію інертного газу з завершеними електронними структурами. Такий стан
- 27. Скачать презентацию






















 Отложения и коррозия
Отложения и коррозия Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов Побочная подгруппа 1 и 2. Медь
Побочная подгруппа 1 и 2. Медь Алкадиены. Непредельные углеводороды
Алкадиены. Непредельные углеводороды Правила ДСС
Правила ДСС Кислоты. Общая характеристика, химические свойства
Кислоты. Общая характеристика, химические свойства Теоретические основы биоорганической химии
Теоретические основы биоорганической химии Алкены. Непредельные углеводороды ряда этилена
Алкены. Непредельные углеводороды ряда этилена Углерод и его оксиды
Углерод и его оксиды Теория сплавов
Теория сплавов Щелочноземельные металлы Положение в периодической таблице
Щелочноземельные металлы Положение в периодической таблице Метангидратное ружье. Задача 3. Команда: Когнитивная машина
Метангидратное ружье. Задача 3. Команда: Когнитивная машина Спирты. Многоатомные спирты
Спирты. Многоатомные спирты Лекция 1 эквивалент 2
Лекция 1 эквивалент 2 Химические свойства кислот
Химические свойства кислот Дисперсные системы. Растворы
Дисперсные системы. Растворы Водород
Водород Химия нефти и газа. Переработка нефти
Химия нефти и газа. Переработка нефти Важнейшие промышленные синтезы на основе переработки нефти и другого углеводородного сырья
Важнейшие промышленные синтезы на основе переработки нефти и другого углеводородного сырья Основные способы получения металлов
Основные способы получения металлов Угольная и кремниевая кислоты и их соли
Угольная и кремниевая кислоты и их соли Магматические горные породы
Магматические горные породы Коллоидная химия
Коллоидная химия Классы неорганических соединений
Классы неорганических соединений Правила техники безопасности в химическом кабинете. Правила пользования лабораторным оборудованием и нагревательными приборами
Правила техники безопасности в химическом кабинете. Правила пользования лабораторным оборудованием и нагревательными приборами Строение атома и периодическая система Д.И. Менделеева
Строение атома и периодическая система Д.И. Менделеева Ізомери в природі
Ізомери в природі Сплавы и их свойства. Легирующие добавки
Сплавы и их свойства. Легирующие добавки