Содержание
- 2. Биоорганическая химия изучает строение и своства веществ, участвующих в процессах жизнедеятельности, в непосредственной связи с познанием
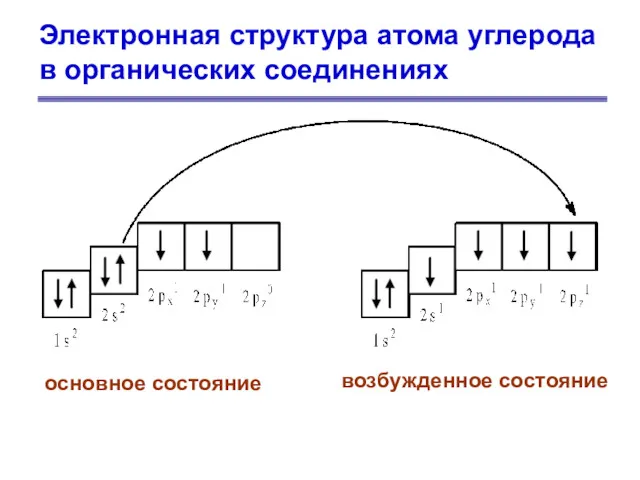
- 3. Электронная структура атома углерода в органических соединениях основное состояние возбужденное состояние
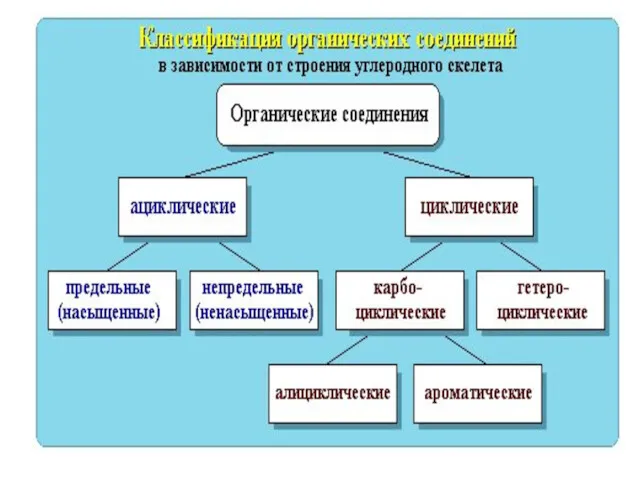
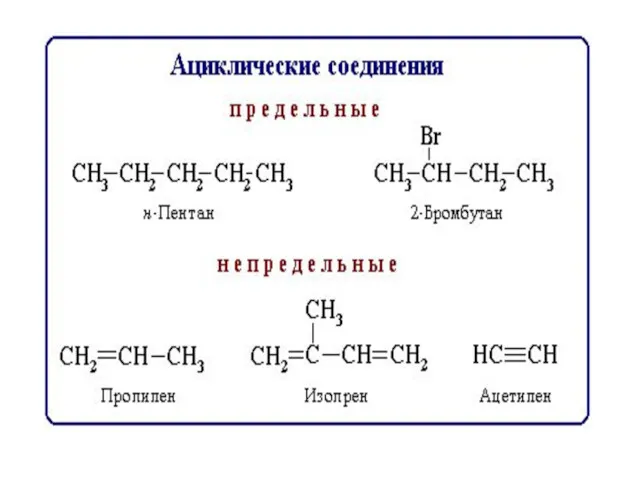
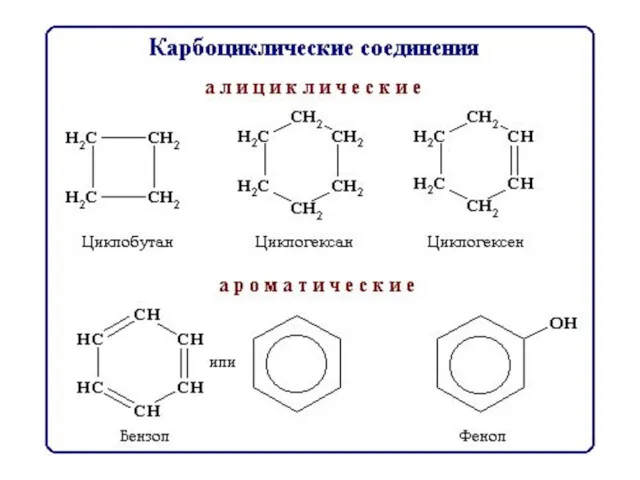
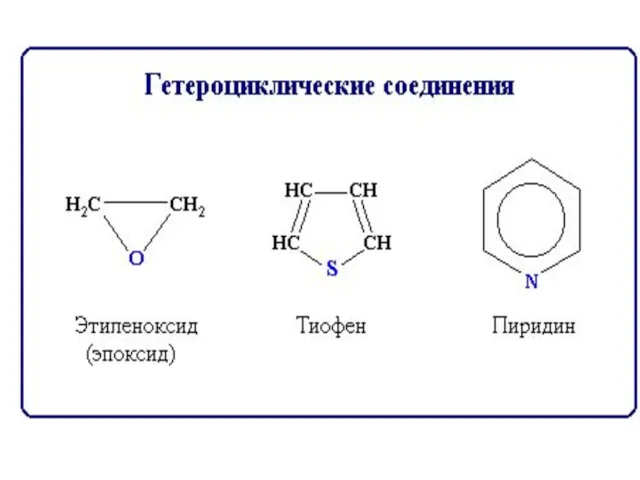
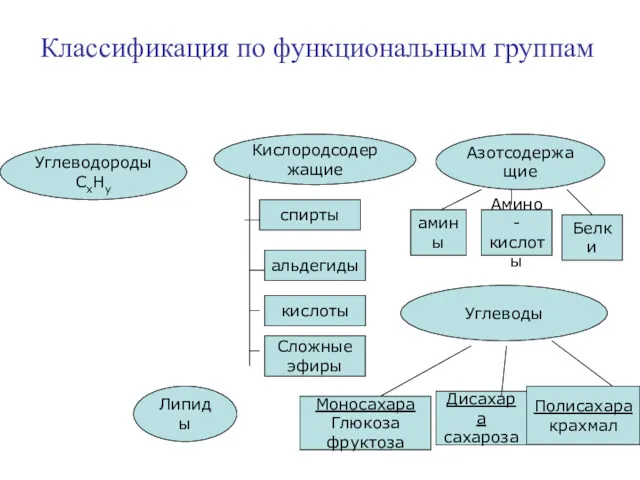
- 8. Классификация по функциональным группам Углеводороды СхНу Кислородсодержащие Азотсодержащие Углеводы Липиды спирты альдегиды кислоты Сложные эфиры амины
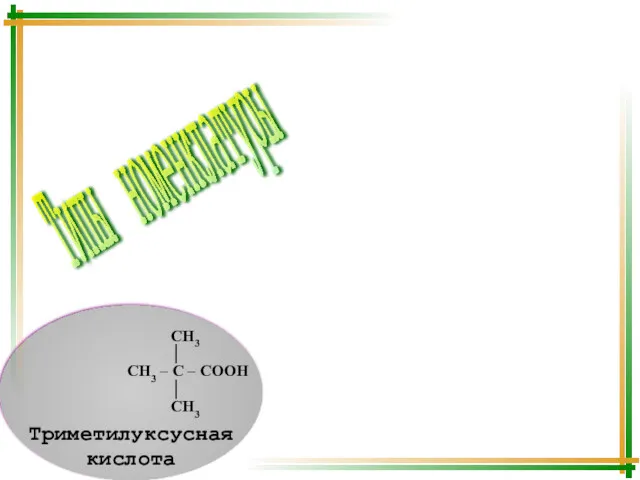
- 9. Типы номенклатуры Систематическая Тривиальная Рациональная Систематическая Рациональная
- 10. Правила номенклатуры IUPAC: (IUPAC - Международный союз чистой и прикладной химии, ИЮПАК) префикс корень суффикс Название
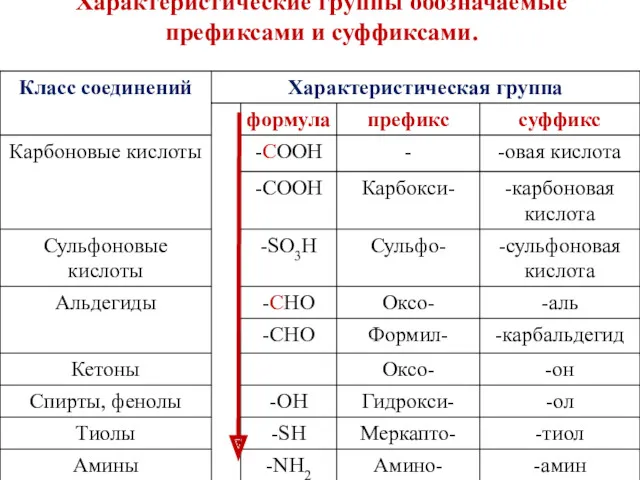
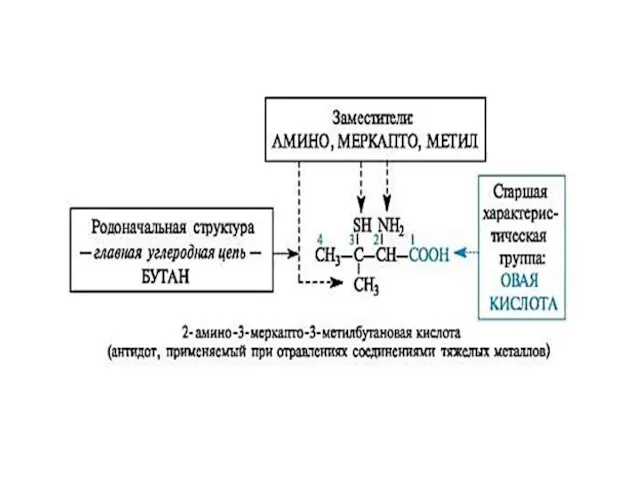
- 11. Характеристические группы обозначаемые префиксами и суффиксами.
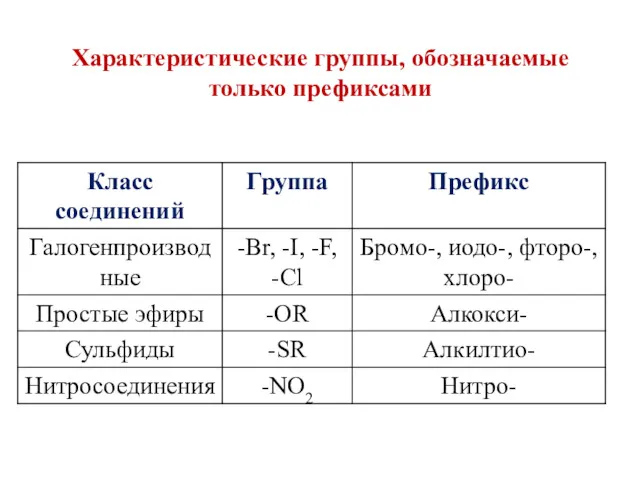
- 12. Характеристические группы, обозначаемые только префиксами
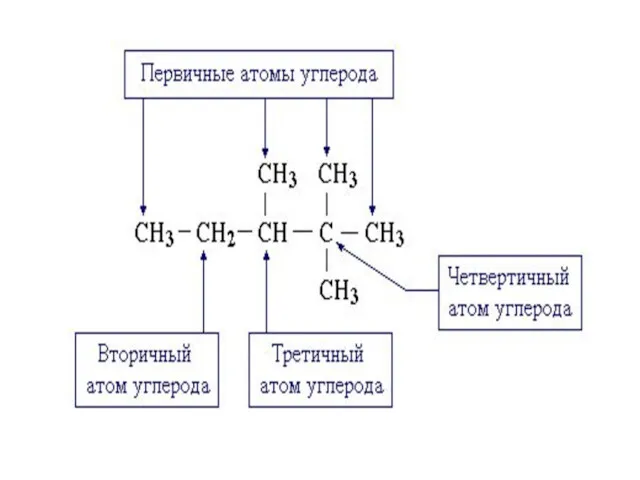
- 13. Важнейшие углеводородные радикалы, обозначаемыми префиксами.
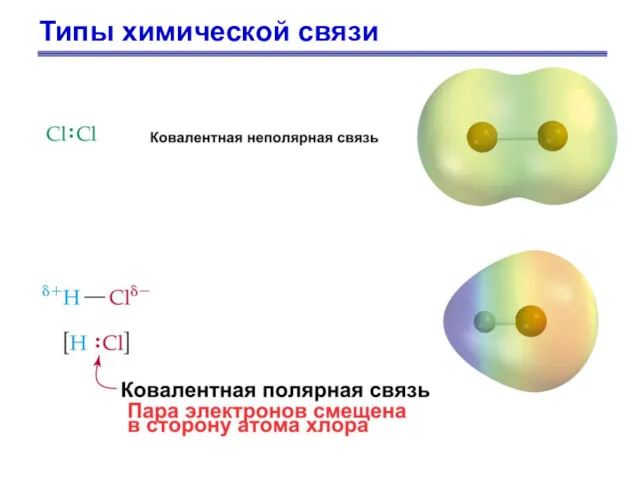
- 16. Типы химической связи
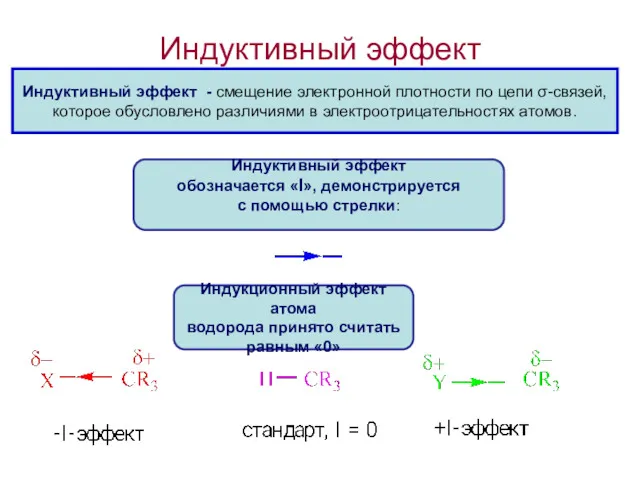
- 17. Индуктивный эффект Индуктивный эффект - смещение электронной плотности по цепи σ-связей, которое обусловлено различиями в электроотрицательностях
- 18. Индуктивный эффект называют отрицательным (-I), если заместитель смещает электронную плотность ϭ-связи от атома углерода, с которым
- 20. Индуктивный эффект называют положительным (+ I), если заместитель увеличивает электронную плотность на атоме углерода, индуцируя на
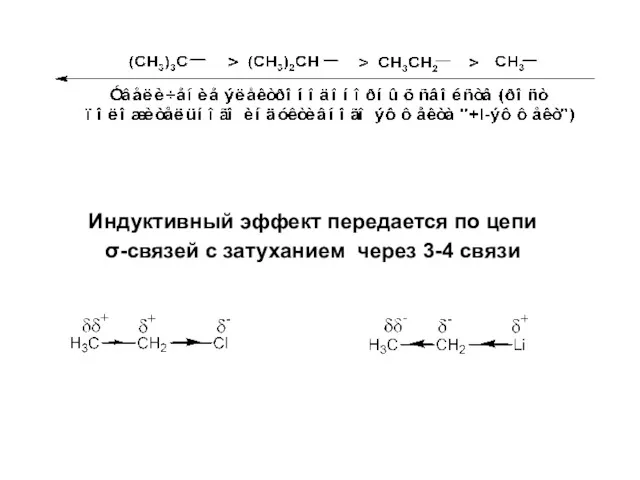
- 21. Индуктивный эффект передается по цепи σ-связей с затуханием через 3-4 связи
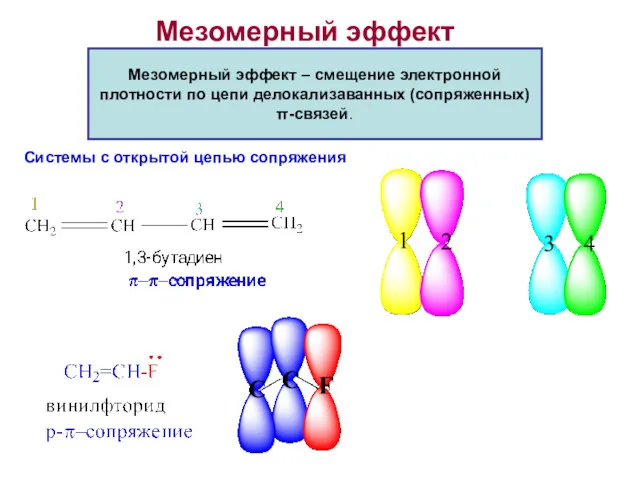
- 22. Мезомерный эффект Мезомерный эффект – смещение электронной плотности по цепи делокализаванных (сопряженных) π-связей. Системы с открытой
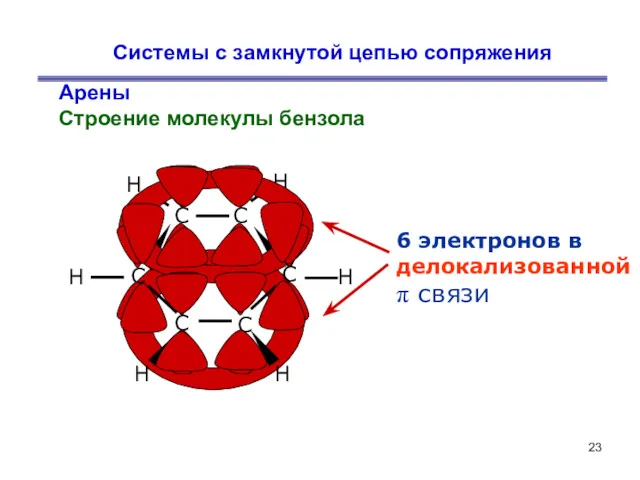
- 23. Системы с замкнутой цепью сопряжения Арены Строение молекулы бензола 6 электронов в делокализованной π связи
- 24. Арены «Ароматичность» – совокупность особых свойств бензола Правило Хюккеля (1931): - плоский замкнутый цикл сопряженная система
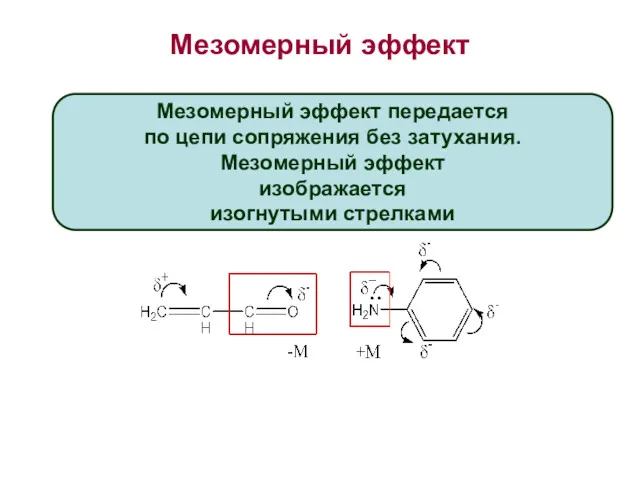
- 25. Мезомерный эффект Мезомерный эффект передается по цепи сопряжения без затухания. Мезомерный эффект изображается изогнутыми стрелками
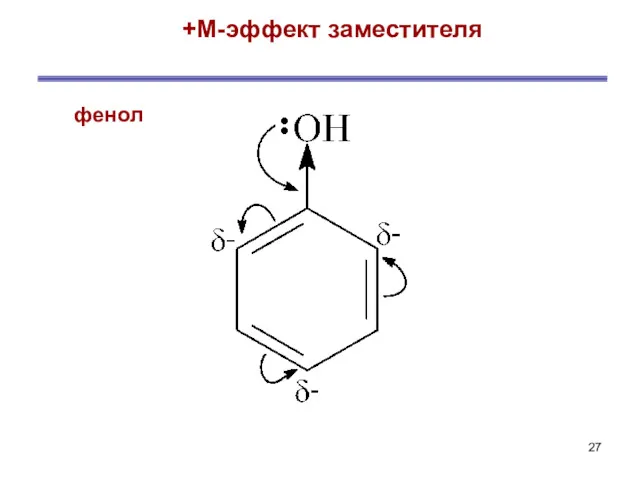
- 26. + М-эффектом обладают заместители, повышающие электронную плотность в сопряженной системе. К ним относятся группы, которые содержат
- 27. +М-эффект заместителя фенол
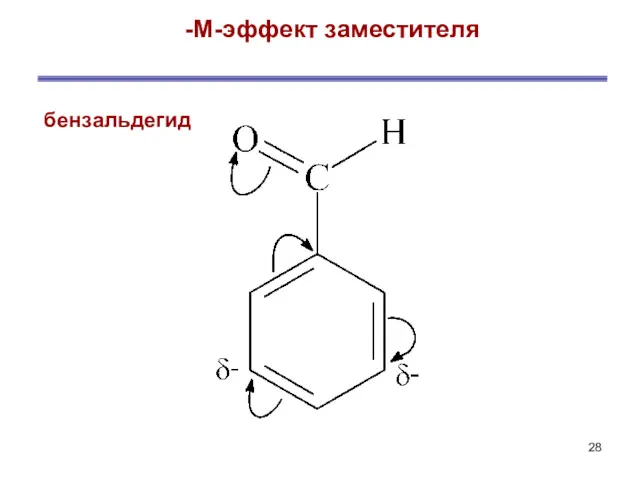
- 28. -М-эффект заместителя бензальдегид
- 29. Классификация органических реакций 1. По типу разрыва связей. A:B А. + B. Гомолитические реакции – симметричный
- 30. - A:B А: + B Е N Гетеролитические реакции – несимметричный разрыв связи, приводящий к появлению
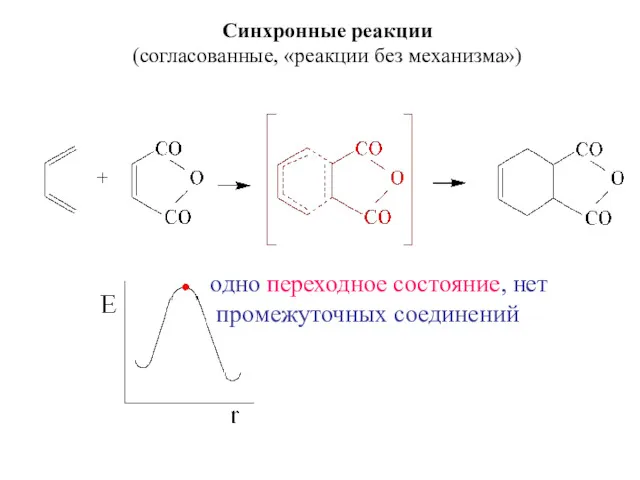
- 31. Синхронные реакции (согласованные, «реакции без механизма») одно переходное состояние, нет промежуточных соединений
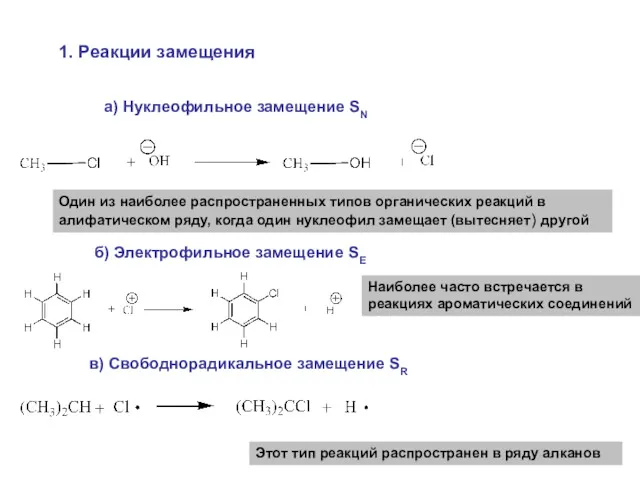
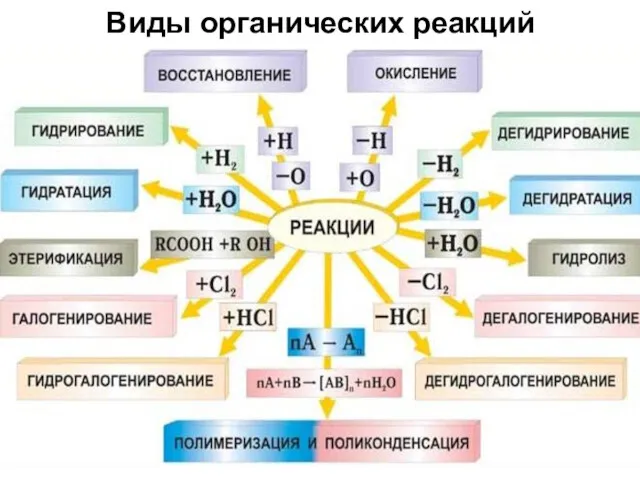
- 32. 2. Классификация по конечному результату 1. Реакции замещения Данный тип реакций обозначают буквой S (от английского
- 33. 1. Реакции замещения а) Нуклеофильное замещение SN Один из наиболее распространенных типов органических реакций в алифатическом
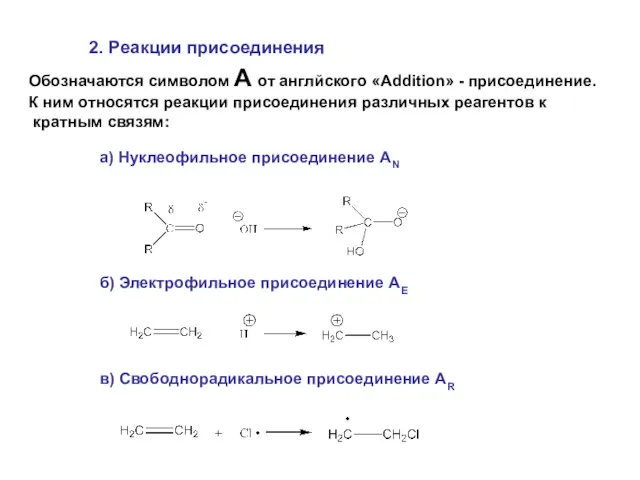
- 34. 2. Реакции присоединения Обозначаются символом A от англйского «Addition» - присоединение. К ним относятся реакции присоединения
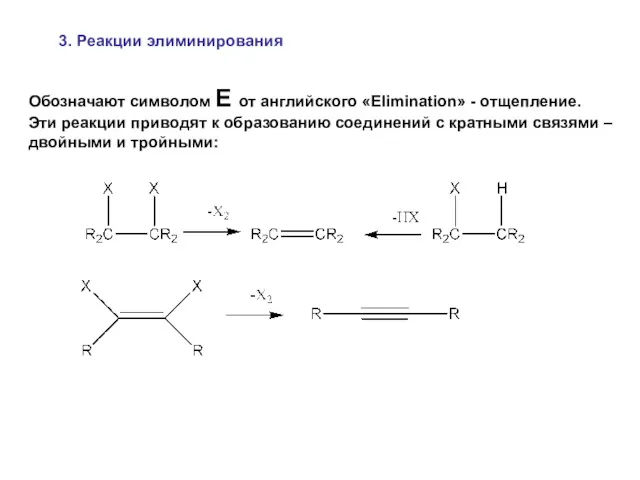
- 35. 3. Реакции элиминирования Обозначают символом E от английского «Elimination» - отщепление. Эти реакции приводят к образованию
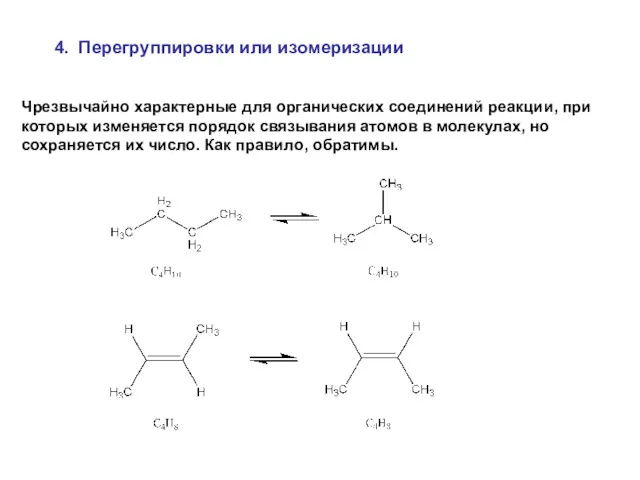
- 36. 4. Перегруппировки или изомеризации Чрезвычайно характерные для органических соединений реакции, при которых изменяется порядок связывания атомов
- 37. 5. Реакции окисления и восстановления Сопровождаются изменением степени окисления атома углерода, Являющегося реакционным центром. 6. Реакции
- 38. В каждой органической реакции различают: субстрат и реагент. Субстрат – вещество, вступающее в реакцию, в которой
- 39. Виды органических реакций
- 40. Кислотность и основность органических соединений.
- 41. 1. Протонная теория Дж.Бренстеда и Т.Лоури Кислоты Бренстеда – нейтральные молекулы или ионы, способные отдавать протон.
- 42. Оценка кислотности 1. Сила кислоты характеризуется K дисс. 2. Качественно сила кислоты оценивается по стабильности сопряженного
- 43. Факторы, определяющие кислотность (стабильность аниона) а) Влияние ЭО атома в кислотном центре. Чем больше ЭО атома
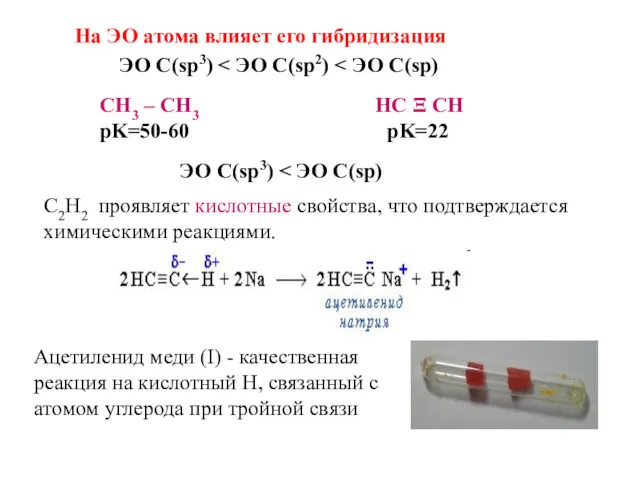
- 44. На ЭО атома влияет его гибридизация СН3 – СН3 НС Ξ СН pK=50-60 pK=22 ЭО С(sp3)
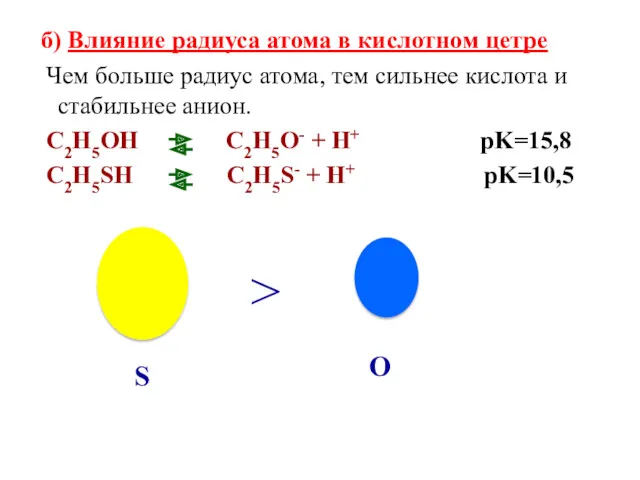
- 45. б) Влияние радиуса атома в кислотном цетре Чем больше радиус атома, тем сильнее кислота и стабильнее
- 46. в) Влияние заместителей Заместители с –I эффектом усиливают кислотность, а с + I эффектом – ослабляют.
- 47. г) Влияние сопряжения Участие в сопряжении усиливает кислотность
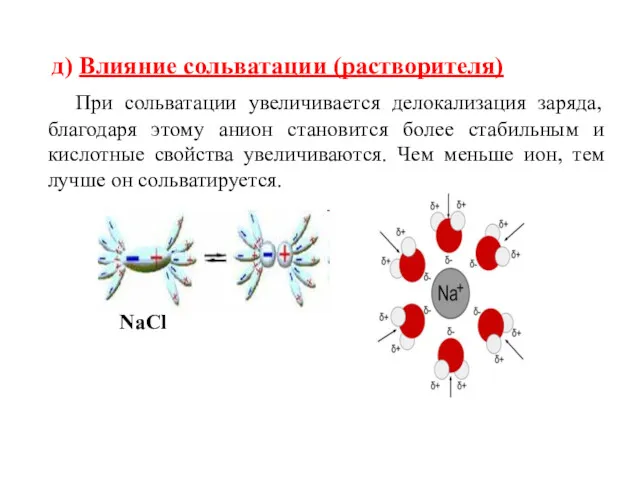
- 48. д) Влияние сольватации (растворителя) При сольватации увеличивается делокализация заряда, благодаря этому анион становится более стабильным и
- 49. Основания Бренстеда – нейтральные молекулы или ионы, способные присоединять протоны (акцепторы Н+). π- основания: молекулы с
- 50. Факторы, влияющие на основность а) Электроотрицательность элемента Чем меньше ЭО, тем сильнее основность б) Размер гетероатома
- 51. 2.Электронная теория Льюиса (1923). Кислота - частица-акцептор электронной пары (H+, BF3, AlCl3). Основание – частица-донор электронной
- 52. Принцип жестких и мягких кислот и оснований (ЖКМО) Пирсона Принцип ЖМКО жесткие кислоты предпочтительно связываются с
- 53. Жесткие кислоты – кислоты, в которых атом-акцептор пары электронов имеет небольшой размер, положительно заряжен, обладает низкой
- 55. Скачать презентацию
























 Фенол и его свойства. (10 класс)
Фенол и его свойства. (10 класс) Темір және оның маңызды қосылыстары
Темір және оның маңызды қосылыстары Химическая промышленность. Минеральные удобрения
Химическая промышленность. Минеральные удобрения Общая характеристика металлов
Общая характеристика металлов Карбонильные соединения. Альдегиды и кетоны
Карбонильные соединения. Альдегиды и кетоны Пестициды. Применение пестицидов
Пестициды. Применение пестицидов Определение витамина “С” в продуктах питания с помощью иодометрии
Определение витамина “С” в продуктах питания с помощью иодометрии Методы определения Тст и Тт полимеров
Методы определения Тст и Тт полимеров Простые и сложные вещества
Простые и сложные вещества Химический элемент йод
Химический элемент йод Физические явления. Способы получения чистых химических веществ с помощью физических явлений
Физические явления. Способы получения чистых химических веществ с помощью физических явлений Виды присадок к моторным топливам (керосин)
Виды присадок к моторным топливам (керосин) Экскурсия по химическому факультету
Экскурсия по химическому факультету Химическая промышленность
Химическая промышленность Соли. Классификация
Соли. Классификация Проект Получение пресной и чистой воды
Проект Получение пресной и чистой воды Маңызды мұнай өнімдері
Маңызды мұнай өнімдері Предмет, история и задачи геохимии, положение среди других наук
Предмет, история и задачи геохимии, положение среди других наук Искусственные полимеры
Искусственные полимеры Марганец и хром
Марганец и хром Смоги и их влияние на человека
Смоги и их влияние на человека Реакции ионного обмена
Реакции ионного обмена Химия и пища». «Белок – основа жизни
Химия и пища». «Белок – основа жизни Химические свойства металлов. Электрохимический ряд напряжения металлов
Химические свойства металлов. Электрохимический ряд напряжения металлов Общие закономерности адсорбции из растворов на поверхности твердого тела. Лекция 05
Общие закономерности адсорбции из растворов на поверхности твердого тела. Лекция 05 Оксиды. Определение
Оксиды. Определение Гидрокси(окси) кислоты
Гидрокси(окси) кислоты Разделение углеводородных газов
Разделение углеводородных газов