Содержание
- 2. Определение Оксиды-это сложные вещество состоящий из двух элементом один из которых кислород которому всегда равен -2.
- 3. Общая формула Общая формула оксидов: ЭхОу Кислород имеет второе по величине значение электроотрицательности (после фтора), поэтому
- 4. Строение оксидов Молекулярное Немолекулярное -Имеют оксиды неметаллических элементов. -Твердые вещества с высокой температурой плавления и кипения.
- 5. Классификация оксидов (с примерами) Кислотные K2O (окись калия), CaO (окись кальция), FeO (окись железа 2-валентного) Основные
- 6. Хим. свойства основных оксидов 1. Растворимые в воде основные оксиды вступают в реакцию с водой, образуя
- 7. Хим.свойства кислотных оксидов 1. Взаимодействуют с водой, образуя кислоту: SO3 + H2O → H2SO4. Но не
- 8. Хим. свойства амфотерных оксидов 1. Взаимодействуют с кислотами, образуя соль и воду: ZnO + 2HCl →
- 10. Скачать презентацию







 Природные источники углеводородов
Природные источники углеводородов 5-я группа элементов
5-я группа элементов Химическое равновесие и условия его смещения
Химическое равновесие и условия его смещения Аминокислоты. Физические свойства. Химические свойства
Аминокислоты. Физические свойства. Химические свойства Простые эфиры
Простые эфиры Генетическая связь между классами неорганических веществ. 8 класс
Генетическая связь между классами неорганических веществ. 8 класс Ионные уравнения
Ионные уравнения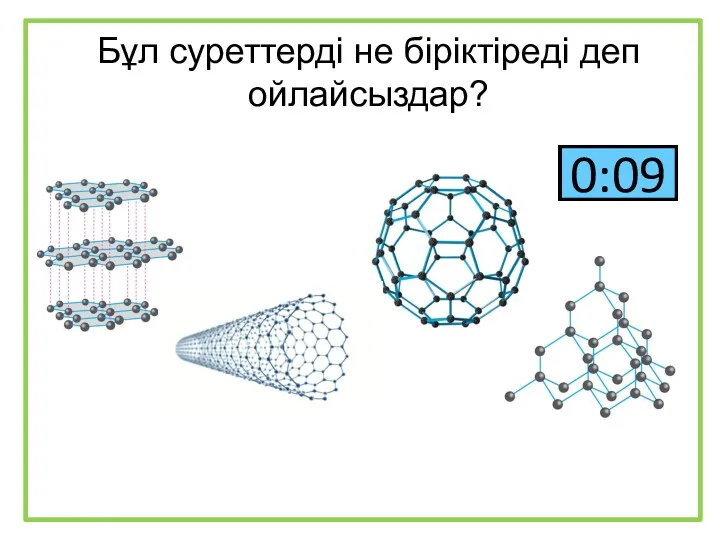 Бұл суреттерді не біріктіреді деп ойлайсыздар?
Бұл суреттерді не біріктіреді деп ойлайсыздар?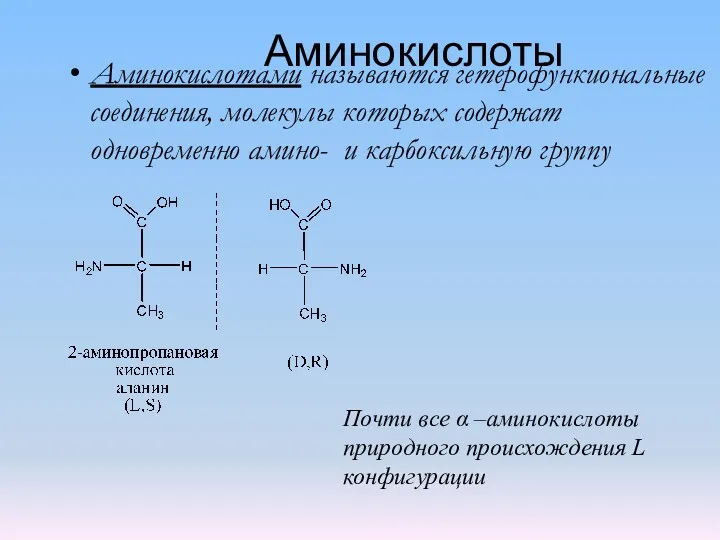 Аминокислоты 1
Аминокислоты 1 Жескость воды
Жескость воды Галогены. Получение и применение галогенов
Галогены. Получение и применение галогенов Углерод. Положение в периодической системе и строение атома
Углерод. Положение в периодической системе и строение атома Чистые вещества и смеси
Чистые вещества и смеси Рідкі кристали та їх властивості
Рідкі кристали та їх властивості Паровые зоны в гидротермальных системах
Паровые зоны в гидротермальных системах Бензол қатарындағы гетерофункционалды туындылары дәрі-дәрмек ретінде
Бензол қатарындағы гетерофункционалды туындылары дәрі-дәрмек ретінде Каталитический синтез нуклеозидов и других пребиотических производных формамида при протонном облучении метеоритов
Каталитический синтез нуклеозидов и других пребиотических производных формамида при протонном облучении метеоритов Масса и формулы (8 класс)
Масса и формулы (8 класс) Гетероциклды қосылыстар. Алкалоидтар
Гетероциклды қосылыстар. Алкалоидтар Окисление и восстановление
Окисление и восстановление Химическая промышленность. География. 9 класс
Химическая промышленность. География. 9 класс Непредельные углеводороды. Этилен и его гомологи
Непредельные углеводороды. Этилен и его гомологи Реакции ионного обмена
Реакции ионного обмена Гидролиз. Классификация солей
Гидролиз. Классификация солей Органическая химия. Ацетилен
Органическая химия. Ацетилен Спирты
Спирты Теория радикалов (30 гг. XIX в Й.Берцелиус, Ю.Либих, Ж.Дюма)
Теория радикалов (30 гг. XIX в Й.Берцелиус, Ю.Либих, Ж.Дюма) Попутные нефтяные газы
Попутные нефтяные газы