Содержание
- 2. Верите ли Вы что…? ФИО ___________________класс_____________
- 3. НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ. ЭТИЛЕН И ЕГО ГОМОЛОГИ.
- 4. Организация урока: 1.Рабочие листы для заполнения-1и2 2.Листы с информацией для каждого ряда: Определение класса алкенов, номенклатура
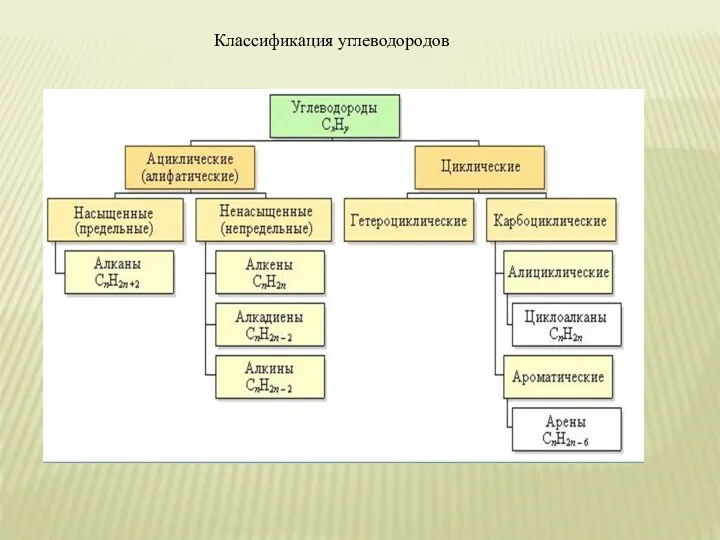
- 5. Классификация углеводородов
- 6. Непредельные, или ненасыщенные, углеводороды ряда этилена (алкены, или олефины)- углеводороды, в молекулах которых между углеродными атомами
- 7. По систематической номенклатуре названия этиленовых углеводородов производят заменой суффикса -ан в соответствующих алканах на суффикс -ен
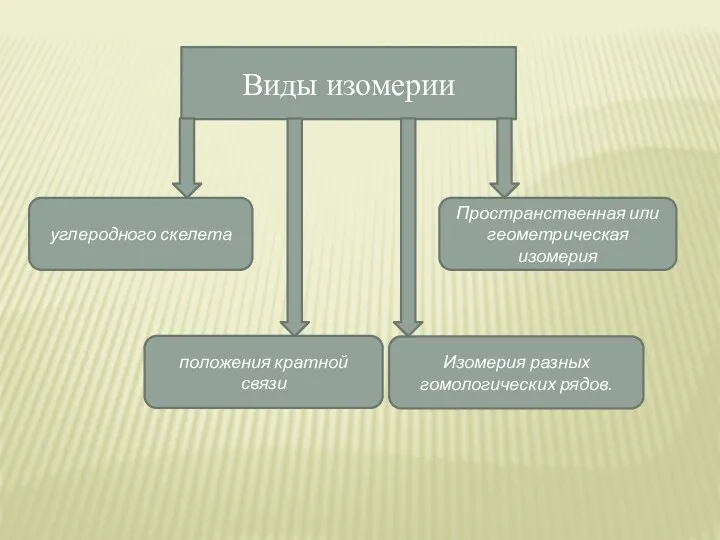
- 8. Виды изомерии углеродного скелета положения кратной связи Изомерия разных гомологических рядов. Пространственная или геометрическая изомерия
- 9. Физические свойства Алкены – этен, пропен и бутен – при обычных условиях (20 °С, 1 атм)
- 10. Получение алкенов: Дегидратация спиртов 2) Дегидрирование алканов 3) Пиролиз и крекинг нефти и природного газа 4)
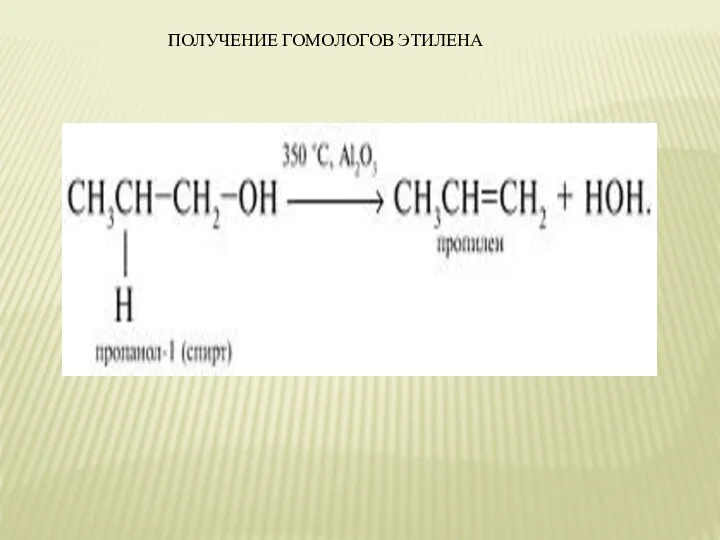
- 12. ПОЛУЧЕНИЕ ГОМОЛОГОВ ЭТИЛЕНА
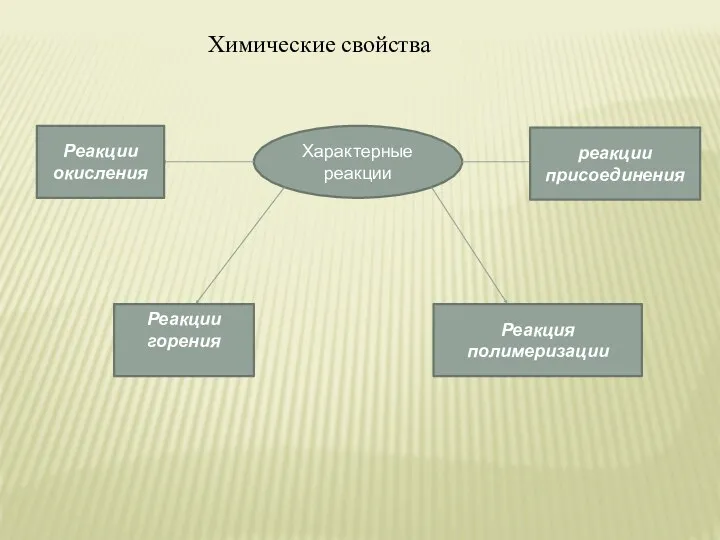
- 13. Химические свойства Характерные реакции Реакции окисления Реакции горения Реакция полимеризации реакции присоединения
- 14. Реакции горения. H2C=CH2 + 3O2 → 2CO2 + 2H2O 2H2C=CH─СН3+ 9O2 → 6CO2 + 6H2O
- 15. Реакции окисления
- 16. Реакции присоединения Гидрирование ( присоединение водорода) 2. Галогенирование ( присоединение галогенов) 3. Гидрогалогенирование ( присоединение галогеноводородов)
- 17. Галогенирование (присоединение галогенов) Гидрирование ( присоединение водорода) H2C=CH2 + Br2→ BrCH2–CH2Br (1,2-дибром-этан) CH3–CH=CH2 + H2 →Ni→
- 18. Гидрогалогенирование H2C=CH2 + HBr → CH3–CH2Br (бромистый этил) Присоединение полярных молекул( галогеноводородов, воды ) к пропену
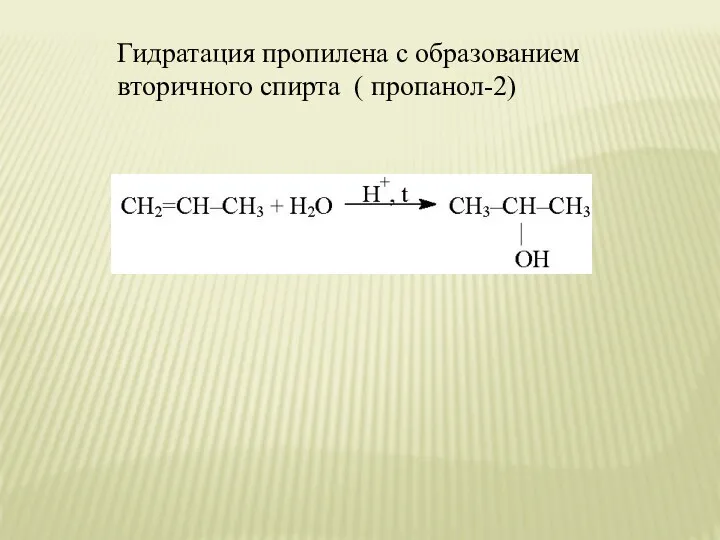
- 19. Гидратация пропилена с образованием вторичного спирта ( пропанол-2)
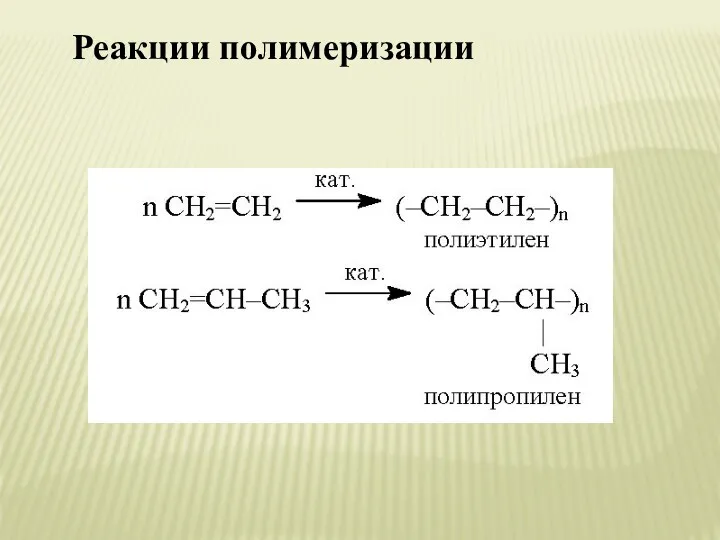
- 20. Реакции полимеризации
- 23. Скачать презентацию













 Автомобильные бензины
Автомобильные бензины Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки
Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки Уран – периодты жүйедегі атомдық номері 92 болатын химиялық элемент
Уран – периодты жүйедегі атомдық номері 92 болатын химиялық элемент Р-элементы VI A группы. Свойства их соединений
Р-элементы VI A группы. Свойства их соединений Basic concepts and laws of chemical thermodynamics
Basic concepts and laws of chemical thermodynamics Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы
Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы Щелочные металлы
Щелочные металлы Химические свойства серной кислоты
Химические свойства серной кислоты Поддержание заданного качества свинцового теплоносителя для энергетических ядерных реакторов
Поддержание заданного качества свинцового теплоносителя для энергетических ядерных реакторов Природный каучук
Природный каучук История открытия химических веществ
История открытия химических веществ Реакция Бэйлиса Хиллмана-Мориты
Реакция Бэйлиса Хиллмана-Мориты Метод окислительно-восстановительного титрования (лекция 7)
Метод окислительно-восстановительного титрования (лекция 7) Вищі карбонові кислоти. Мила. Синтетичні миючі засоби
Вищі карбонові кислоти. Мила. Синтетичні миючі засоби Аурум
Аурум Атомно-кристаллическое строение материалов
Атомно-кристаллическое строение материалов Алкены
Алкены Бензол. Бензол гомологтары. Фенолдар және ароматты аминдер
Бензол. Бензол гомологтары. Фенолдар және ароматты аминдер Природный газ и его свойства. Раздел 1
Природный газ и его свойства. Раздел 1 Сероводород. Сульфиды
Сероводород. Сульфиды Силикаты. Гранат. Берилл
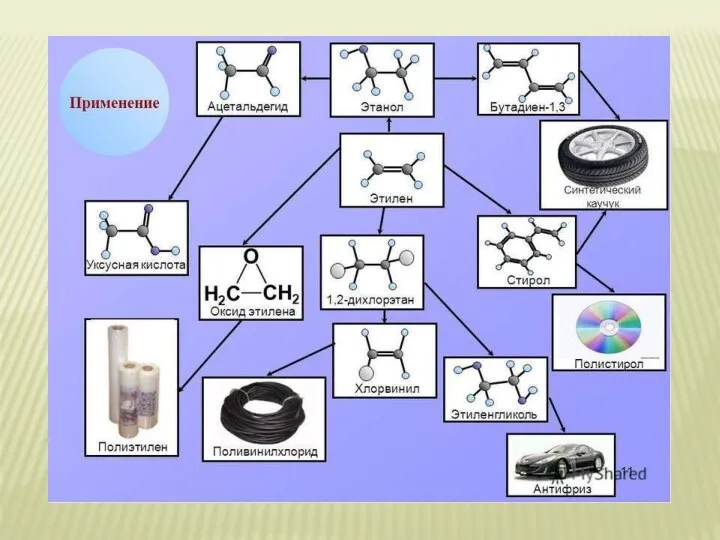
Силикаты. Гранат. Берилл Получение и приминение этилена
Получение и приминение этилена Экспертные системы распознавания химических веществ. Тест
Экспертные системы распознавания химических веществ. Тест Xимия. Cr, Cu, Fe, Zn
Xимия. Cr, Cu, Fe, Zn Сероводород. Сульфиды
Сероводород. Сульфиды Маңызды мұнай өнімдері
Маңызды мұнай өнімдері Разнообразие неметаллов
Разнообразие неметаллов Химическая термодинамика. Кинетика химических реакций. Химическое равновесие
Химическая термодинамика. Кинетика химических реакций. Химическое равновесие