Содержание
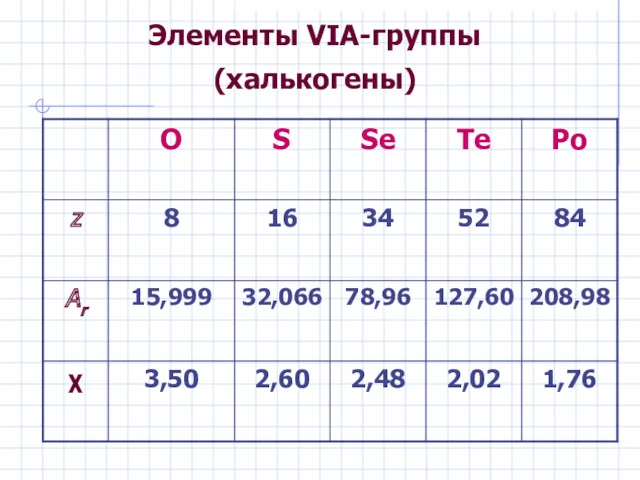
- 3. Элементы VIА-группы (халькогены)
- 4. Элементы VIА-группы (халькогены) Общая электронная формула: […] ns 2 (n–1)d 10np 4 Степени окисления: O: –II,
- 5. Простые вещества Аллотропия: O2, O3 (озон) S8(ромбич.), S8 (монокл.), S6, S4, Sx (пластич.), S2 Se красн.
- 6. Взаимодействие с водой, кислотами и щелочами O2, S(т), Se(т), Te(т) + H2O(ж) ≠ 3S + 2H2O
- 7. Соединения Э–II H2O H2S H2Se H2Te ΔG °, кДж/моль –229 –34 +16 +85 Kк (H2Э/HЭ–, водн.
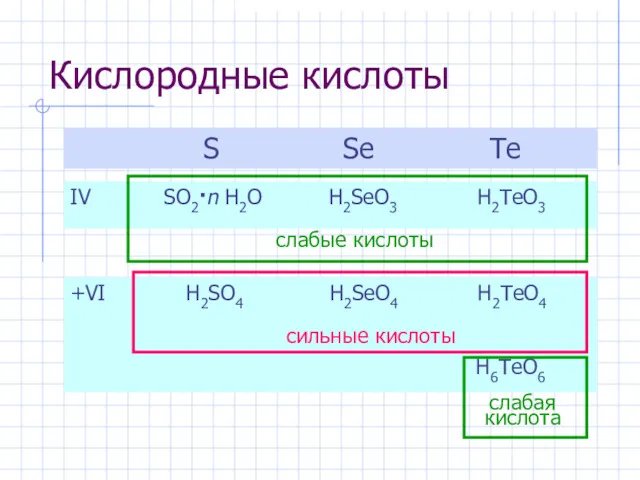
- 8. Кислородные кислоты S Se Te IV SO2·n H2O H2SeO3 H2TeO3 +VI H2SO4 H2SeO4 H2TeO4 H6TeO6
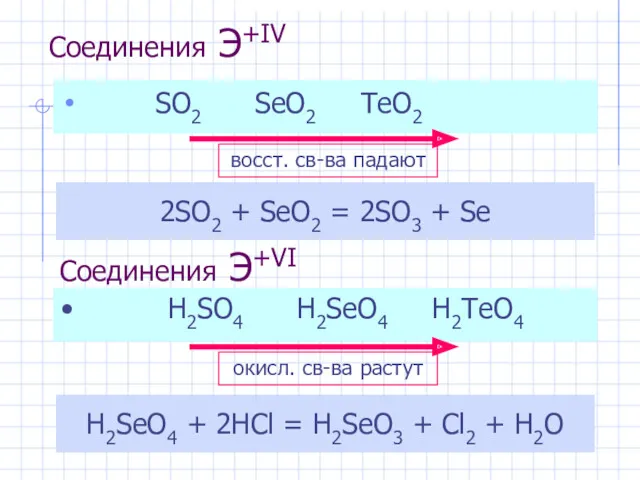
- 9. Соединения Э+IV SO2 SeO2 TeO2 2SO2 + SeO2 = 2SO3 + Se Соединения Э+VI H2SeO4 +
- 10. Соединения Э+VI SeO42– + 4H+ + 2e − = H2SeO3 + H2O Е° = +1,15 В
- 11. В природе 1. O 49,5 % (масс.) 15. S 0,048 % 60. Se 8·10–5 % 74.
- 12. История открытия кислорода В 1772 году К. Шееле, шведский химик, получил «огненный газ» (так он называл
- 13. История открытия Se, Te, Po Теллур открыл в 1782 г. Ф. Мюллер фон Райхенштайн (название дал
- 14. Кислород Кислород – самый распространенный элемент на Земле (49,5% масс.). Кислород существует в самородном виде (воздух)
- 15. Шкала степеней окисления кислорода OF2 O2F2 O2, O3, O0 H2O2, Na2O2, BaO2 OH−, H2O, Na2O, SO3,
- 16. Физические и химические свойства O2 O2 – газ без цвета, запаха и вкуса, т.пл. –218,7 °С,
- 17. Озон O3 O3 – светло-синий газ, т.пл. –192,7 °С, т.кип. –111,9 °С, взрывоопасен и ядовит. В
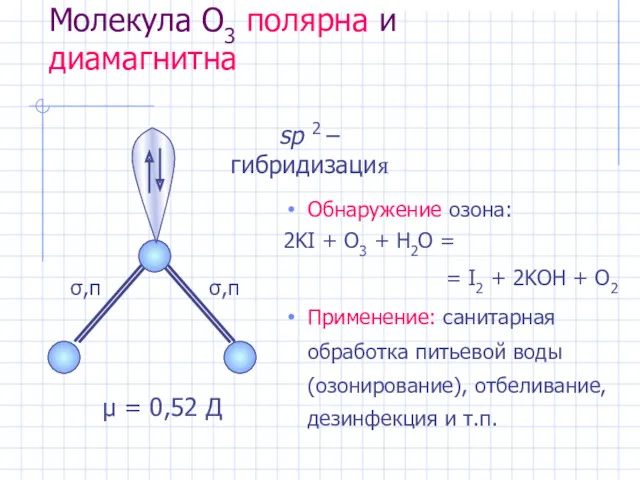
- 18. Молекула O3 полярна и диамагнитна Обнаружение озона: 2KI + O3 + H2O = = I2 +
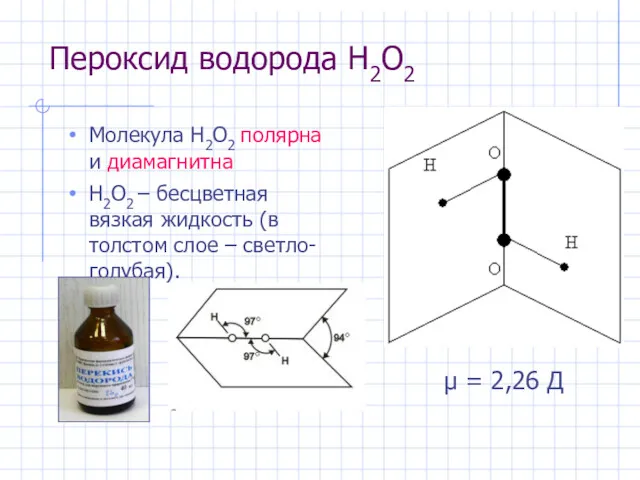
- 19. Пероксид водорода H2O2 Молекула H2O2 полярна и диамагнитна H2O2 – бесцветная вязкая жидкость (в толстом слое
- 20. Физические свойства H2O и H2O2 Водородные связи: H2O ··· H2O ··· H2O ··· H2O ··· H2O
- 21. Пероксид водорода H2O2 Диспроп-вание в присутствии катализаторов (например MnO2): 2H2O2–I = 2H2O–II + O20↑ Видеофрагмент Окислительные
- 22. Протолиз в водном растворе Пероксид водорода – очень слабая двухосновная кислота: H2O2 + H2O ⮀ HO2−
- 23. Окислительно-восстановительные св-ва Окислительные свойства В кислотной среде: H2O2 + 2H+ + 2e − = 2H2O; Е°
- 24. Получение H2O2 В лаборатории: 2BaO + O2 = 2BaO2 BaO2 + H2SO4(конц., хол.) = BaSO4↓ +
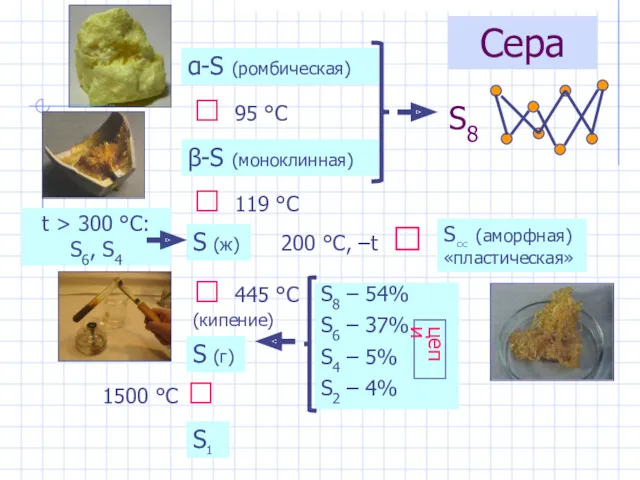
- 25. Сера α-S (ромбическая) β-S (моноклинная) ⮃ 95 °С ⮃ 119 °С S (ж) ⮃ 445 °С
- 26. Шкала степеней окисления серы SO3, SO42−, HSO4−, H2SO4, K2SO4, SF6, SCl2O2 SO2, SO32−, HSO3−, SO2·n H2O,
- 28. Скачать презентацию
![Элементы VIА-группы (халькогены) Общая электронная формула: […] ns 2 (n–1)d](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/156628/slide-3.jpg)

















 Алкалоиды и принципы их классификации
Алкалоиды и принципы их классификации Бензол молекуласында байланыстардың түзілу сызбанұсқасы
Бензол молекуласында байланыстардың түзілу сызбанұсқасы Химическая кинетика
Химическая кинетика Суспензии: получение, свойства
Суспензии: получение, свойства Сахар - вред или польза?
Сахар - вред или польза? Периодический закон и периодическая система элементов Д.И. Менделеева. Лекция 3
Периодический закон и периодическая система элементов Д.И. Менделеева. Лекция 3 Группа щелочных габброидов
Группа щелочных габброидов Степень окисления химических элементов
Степень окисления химических элементов Ферменты. Размеры ферментов и их строение
Ферменты. Размеры ферментов и их строение Медициналық тәжірибедегі потенциометриялар
Медициналық тәжірибедегі потенциометриялар Галогенопроизводные углеводородов 1
Галогенопроизводные углеводородов 1 Асфальтены в тяжелых нефтях и битумах. Химическое строение и влияние на свойства
Асфальтены в тяжелых нефтях и битумах. Химическое строение и влияние на свойства Полимеры. Классификация. Строение
Полимеры. Классификация. Строение Дисперсные системы
Дисперсные системы Құймалар. Механикалық қоспа
Құймалар. Механикалық қоспа Hydrochloric acid HCl
Hydrochloric acid HCl Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу
Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу Каучук. История открытия
Каучук. История открытия Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6
Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6 Методы исследования гидрохимического режима водоемов
Методы исследования гидрохимического режима водоемов Електроннокаталітична переробка діоксиду вуглецю в формальдегід та метанол при атмосферному тиску
Електроннокаталітична переробка діоксиду вуглецю в формальдегід та метанол при атмосферному тиску Ароматичні вуглеводні (Арени). Бензен
Ароматичні вуглеводні (Арени). Бензен Химические свойства солей
Химические свойства солей Основы квантовой химии
Основы квантовой химии Важнейшие нефтепродукты. Области их применения
Важнейшие нефтепродукты. Области их применения Кислородсодержащие органические соединения. Лабораторная работа
Кислородсодержащие органические соединения. Лабораторная работа Процессы и операции формообразования. Металлургия цветных металлов
Процессы и операции формообразования. Металлургия цветных металлов Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации