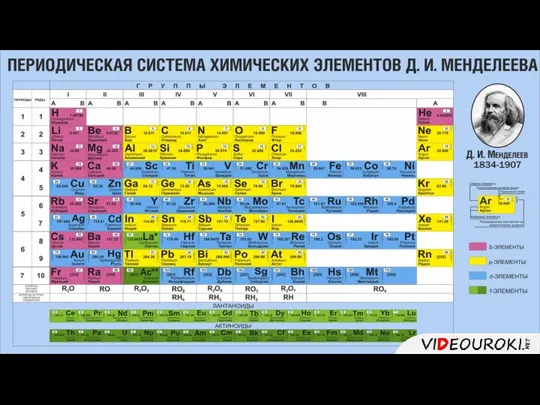
Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева презентация
Содержание
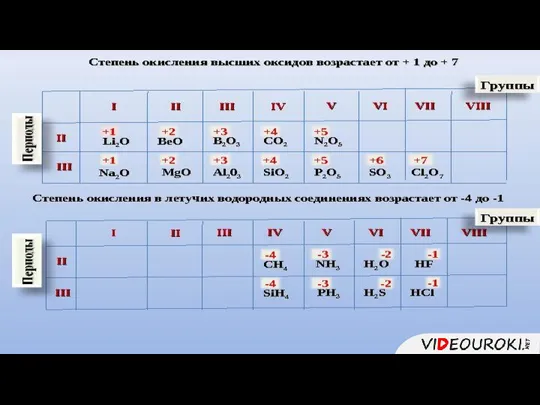
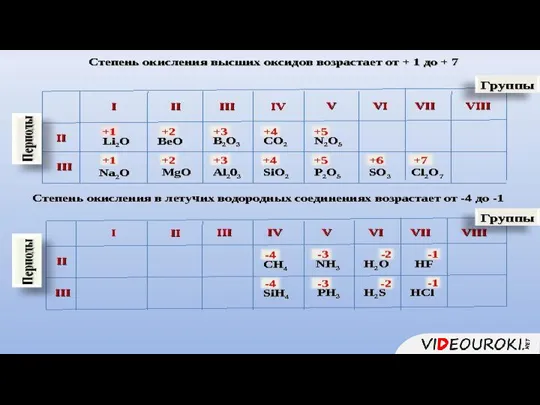
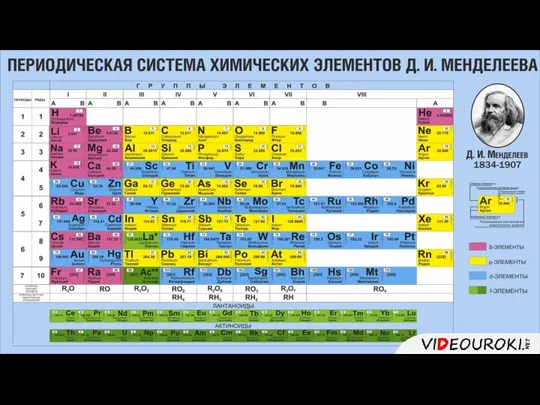
- 2. 1. Описывать элемент следует по 7 пунктам
- 7. 1. Состав высшего оксида, его характер (основный, кислотный, амфотерный)
- 8. 1. Состав высшего гидроксида, его характер (кислородсодержащая кислота, основание, амфотерный гидроксид)
- 13. Порядковый номер 11 Массовое число 23 (А = 23) Заряд ядра +11 Z = +11 В
- 14. Na ) ) ) 2 8 1 Восстановительные свойства Металл
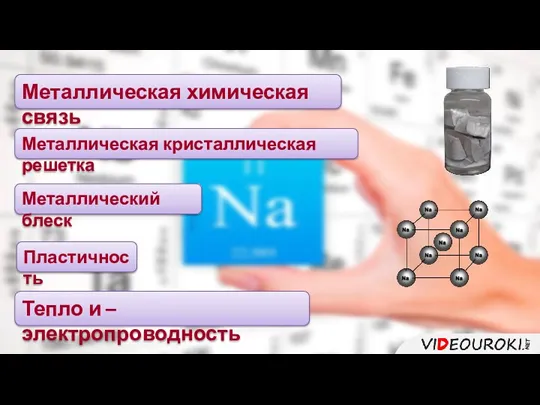
- 15. Металлическая химическая связь Металлическая кристаллическая решетка Металлический блеск Пластичность Тепло и – электропроводность
- 18. Na2O Основный оксид Реагирует с кислотами Реагирует с кислотными оксидами Реагирует с водой Оксид натрия Гидроксид
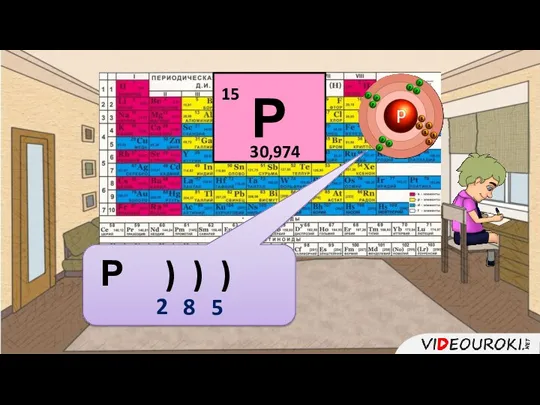
- 19. Порядковый номер 15 Массовое число 31 (А = 31) Заряд ядра +15 Z = +15 В
- 20. Р ) ) ) 2 8 5
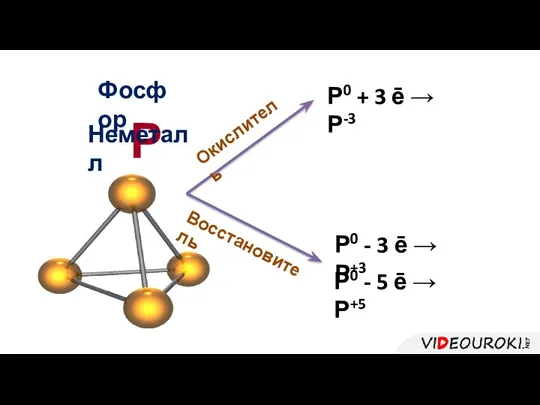
- 21. Р Фосфор Окислитель Р0 + 3 ē → Р-3 Восстановитель Р0 - 3 ē → Р+3
- 22. Фосфор – неметалл Характерно явление аллотропии Белый фосфор Красный фосфор Чёрный фосфор
- 26. Скачать презентацию














 Относительные атомные и молекулярные массы
Относительные атомные и молекулярные массы Прикладные аспекты химии поверхностно-активных веществ
Прикладные аспекты химии поверхностно-активных веществ Липиды. Классификация липидов
Липиды. Классификация липидов Золото. История открытия
Золото. История открытия Химическая кинетика
Химическая кинетика Квантово-механический подход к описанию строения атомов
Квантово-механический подход к описанию строения атомов Органическая химия
Органическая химия Химические свойства основных оксидов
Химические свойства основных оксидов Гідроліз солей
Гідроліз солей Водород. Изотопы водорода. Свойства, получение и применение водорода. Топливные элементы
Водород. Изотопы водорода. Свойства, получение и применение водорода. Топливные элементы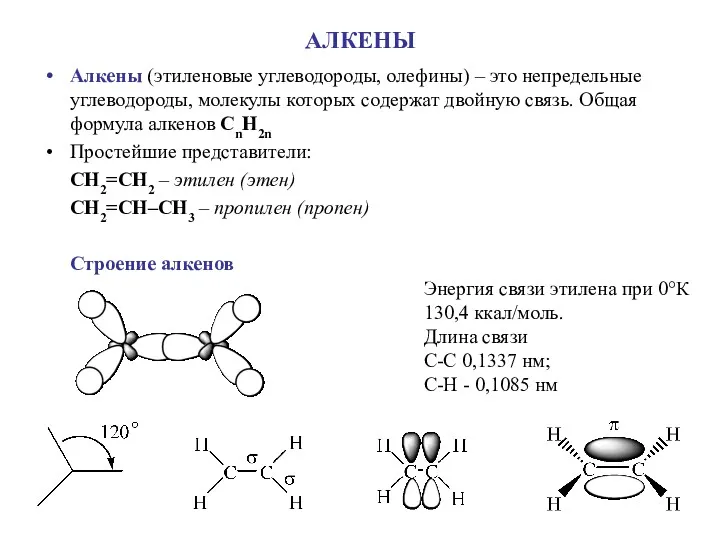 Алкены (этиленовые углеводороды, олефины)
Алкены (этиленовые углеводороды, олефины) Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Тіршілік процесіне қатысатын гетерофункционалды қосылыстар
Тіршілік процесіне қатысатын гетерофункционалды қосылыстар Алкины. Тема 4
Алкины. Тема 4 Оксиды. 9 класс
Оксиды. 9 класс Понятие об алкинах
Понятие об алкинах Никель – тяжелый металл
Никель – тяжелый металл Синтетичні волокна
Синтетичні волокна Предмет и задачи химии. Вещества и их свойства (продолжение)
Предмет и задачи химии. Вещества и их свойства (продолжение)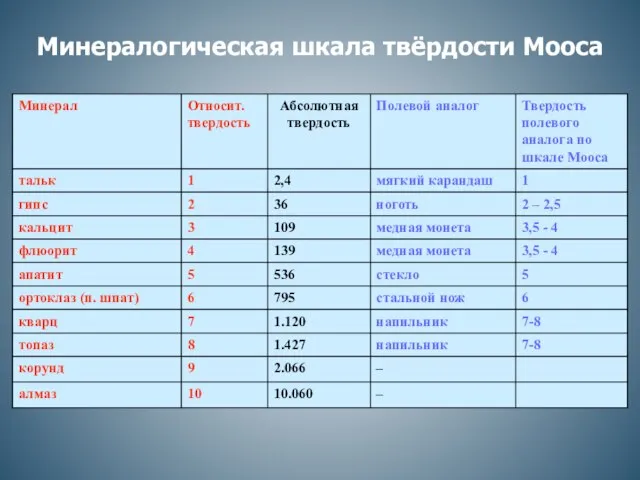 Минералогическая шкала твёрдости Мооса
Минералогическая шкала твёрдости Мооса Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения
Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Фосфор и его соединения. Электронные формулы атома фосфора
Фосфор и его соединения. Электронные формулы атома фосфора Химия и современный быт человека
Химия и современный быт человека Свойства воды
Свойства воды Введение в органическую химию
Введение в органическую химию Соляная кислота (HCI)
Соляная кислота (HCI) Алкены. Состав, строение, свойства и химические превращения
Алкены. Состав, строение, свойства и химические превращения