Содержание
- 3. 1. Гомологический ряд. Общая формула Непредельные углеводороды, содержащие в молекуле тройную связь, называются алкинами или ацетиленовыми
- 4. 2. Структурная изомерия алкинов Структурная изомерия алкинов определяется строением углеродной цепи и положением в ней тройной
- 5. Структурная изомерия, обусловленная строением углеродного скелета, начинается с С5Н8: СН3—СН2—СН2—С ≡ СН пентин-1 СН3—С ≡ С—СН2—СН3
- 6. 3. Номенклатура алкинов По международной заместительной номенклатуре алкины называют, пользуясь теми же правилами, что и в
- 7. Номенклатура алкинов СН3—СН2—СН2—С ≡ СН пентин-1 СН3—С ≡ С—СН2—СН3 пентин-2 СН3—СН—С ≡ СН | СН3 2-метилбутин-1
- 8. 4. Способы получения алкинов 1. Прямой синтез ацетилена Ацетилен может быть получен прямым синтезом из элементов
- 9. 2. Пиролиз природных газов и нефти В промышленности ацетилен получают из природного газа или углеводородов нефти
- 10. 3. Синтез из оксида углерода и водорода Сравнительно недавно был предложен еще один промышленный способ получения
- 11. 4. Получение из карбида кальция (карбидный способ) Ацетилен удобно получать в лаборатории из карбида кальция при
- 13. 4.2. Способы получения гомологов ацетилена 1. Получение из дигалогенопроизводных алканов. Алкины получаются при действии спиртовых растворов
- 14. 5. Физические свойства и строение алкинов Ацетиленовые углеводороды, содержащие в молекуле от двух до четырех углеродных
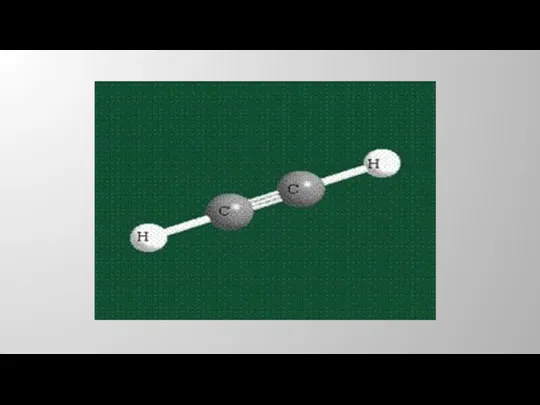
- 15. Пространственное строение ацетилена 0,106нм 0,121нм 0,106нм Электронографическое исследование молекулы ацетилена показало, что ацетиленовая группировка имеет линейное
- 17. Пространственное строение ацетилена Углеродные атомы в молекуле ацетилена находятся в состоянии sр-гибридизации. Это означает, что каждый
- 18. Схематическое изображение строения молекулы ацетилена
- 19. 6. Химические свойства алкинов Химические свойства алкинов определяются особенностями строения тройной связи. Для алкинов характерны следующие
- 20. 6.1. Реакции присоединения 1. Гидрирование алкинов Алкины присоединяют водород в присутствии катализаторов (Pt, Pd, Ni) Гидрирование
- 21. 2. Галогенирования алкинов При взаимодействии алкинов с галогенами вначале образуются дигалогеналкены, которые затем превращаются в тетрагалогензамещенные
- 22. 3. Гидрогалогенирования алкинов Реакция присоединения галогеноводородов также протекает в две стадии, причем в случае несимметричных алкинов
- 23. Присоединение к ацетилену хлороводорода в присутствии катализатора (AlCl3) приводит к образованию винилхлорида: 3. Гидрогалогенирования алкинов [AlCl3]
- 24. 4. Гидратация алкинов (реакция Кучерова) Большое значение для промышленного синтеза кетонов и альдегидов имеет реакция присоединения
- 25. 6.2. Реакции окисления 1. Полное окисление (горение алкинов) Примечательной является реакция горения ацетилена, которая широко используется
- 26. 2. Неполное окисление алкинов Алкины труднее вступают в реакции окисления, чем алкены. Обесцвечивание нейтрального раствора перманганата
- 27. [O] СН3‒С ≡ С‒СН3 ⎯⎯→ 2 СН3‒СООН бутин-2 уксусная кислота [O] СН3‒СН2‒С ≡ С‒СН3 ⎯⎯→ СН3‒СН2‒СООН
- 28. 6.3. Реакции полимеризации Ацетиленовые углеводороды ввиду наличия тройной связи весьма склонны к реакциям полимеризации. В зависимости
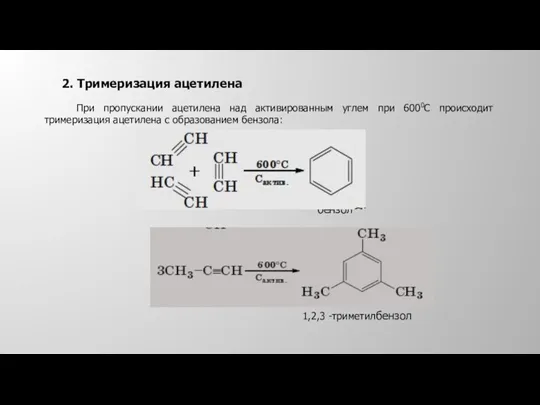
- 29. 2. Тримеризация ацетилена При пропускании ацетилена над активированным углем при 6000С происходит тримеризация ацетилена с образованием
- 30. 6.4. Реакции замещения ацетиленового атома водорода Водородные атомы в молекуле ацетилена Н‒С≡С‒Н и его моноалкилпроизводных R―C
- 31. При взаимодействии с сильными основаниями (например, амидом натрия) алкины, содержащие концевую тройную связь, образуют соли –
- 32. Качественной реакцией на атом водорода при тройной связи является образование ацетиленидов серебра, а также ацетиленидов одновалентной
- 33. Аналогично аммиачный раствор хлорида меди (I) вступает в реакции с ацетиленом или с его моноалкилпроизводными с
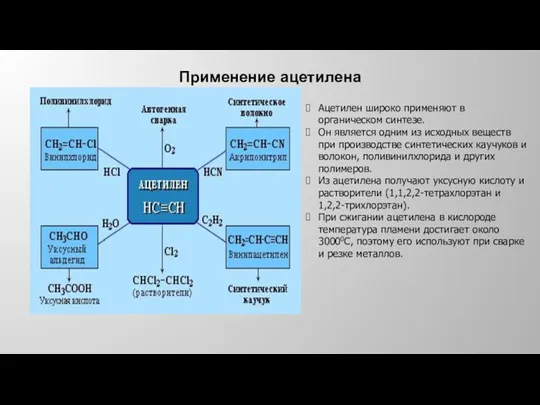
- 34. Применение ацетилена Ацетилен широко применяют в органическом синтезе. Он является одним из исходных веществ при производстве
- 36. Скачать презентацию
























![[O] СН3‒С ≡ С‒СН3 ⎯⎯→ 2 СН3‒СООН бутин-2 уксусная кислота](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/316107/slide-26.jpg)





 Ионоселективные электроды
Ионоселективные электроды Дисперсные системы. Дисперсное состояние вещества. Лекция 10
Дисперсные системы. Дисперсное состояние вещества. Лекция 10 Роль побутової хімії у житті
Роль побутової хімії у житті Мыло. Его состав и моющее действие. Синтетические моющие средства
Мыло. Его состав и моющее действие. Синтетические моющие средства Основні закони хімії.Класи та номенклатура неорганічних сполук
Основні закони хімії.Класи та номенклатура неорганічних сполук Медь и её сплавы
Медь и её сплавы Общая характеристика неметаллов
Общая характеристика неметаллов Химия - тұрмыста
Химия - тұрмыста Металдар арасындағы беттік керіліс
Металдар арасындағы беттік керіліс Теоретические аспекты
Теоретические аспекты Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Коррозия металлов
Коррозия металлов Кристаллические решётки и их виды
Кристаллические решётки и их виды Галогены. Положение в ПСХЭ Д.И. Менделеева
Галогены. Положение в ПСХЭ Д.И. Менделеева Серная кислота H2SO4
Серная кислота H2SO4 Аллотропия
Аллотропия Растворы. Процесс растворения
Растворы. Процесс растворения Общие свойства металлов
Общие свойства металлов Определение качества нефтепродуктов (на примере бензинов и дизельного топлива)
Определение качества нефтепродуктов (на примере бензинов и дизельного топлива) Алкены – непредельные углеводороды. Получение, химические свойства и применение
Алкены – непредельные углеводороды. Получение, химические свойства и применение Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Электрохимические процессы. Лекция 7
Электрохимические процессы. Лекция 7 Общая характеристика элементов V-А-группы. Азот
Общая характеристика элементов V-А-группы. Азот Задачник. Основные физические величины в химии
Задачник. Основные физические величины в химии Новое направление в бизнесе компании – катализаторы синтеза метанола
Новое направление в бизнесе компании – катализаторы синтеза метанола Сложноэфирная конденсация Кляйзена-Шмидта
Сложноэфирная конденсация Кляйзена-Шмидта Warm-Up
Warm-Up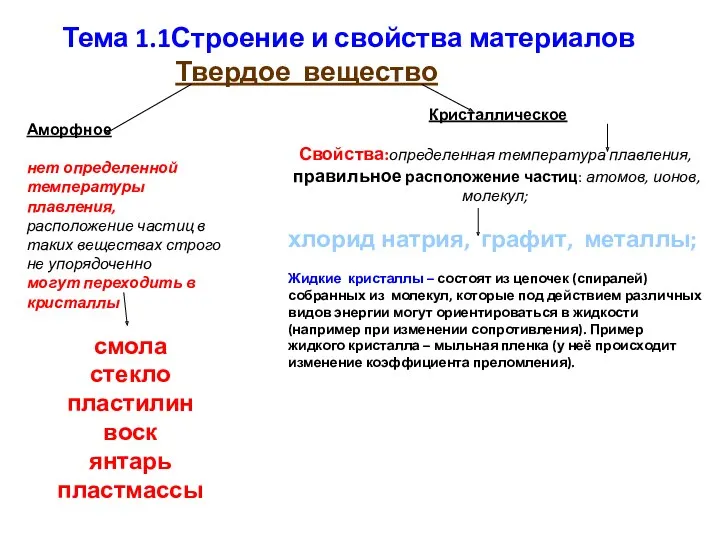 Строение и свойства материалов. Тема 1.1
Строение и свойства материалов. Тема 1.1