Содержание
- 2. Дисперсные системы – это системы, состоящие из частиц дисперсной фазы (раздробленного вещества) и дисперсионной среды (растворителя).
- 3. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Особенности коллоидного состояния Высокая степень раздробленности вещества (дисперсности D): Количественной мерой дисперсности служат:
- 4. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ 2. Гетерогенность - это наличие 2-х, как минимум фаз: дисперсная фаза и дисперсионная
- 5. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ 1. Классификация дисперсных систем по дисперсности: а) Грубодисперсные системы см; б) Микрогетерогенные: см;
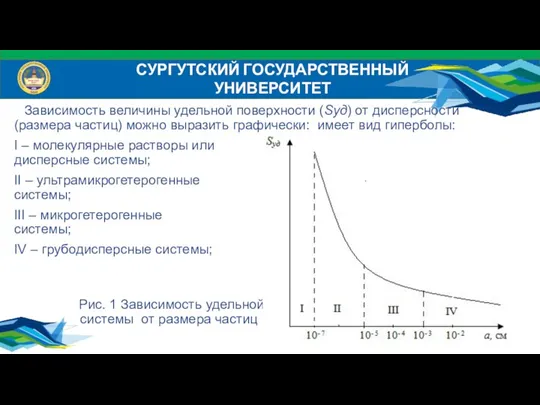
- 6. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Зависимость величины удельной поверхности (Sуд) от дисперсности (размера частиц) можно выразить графически: имеет
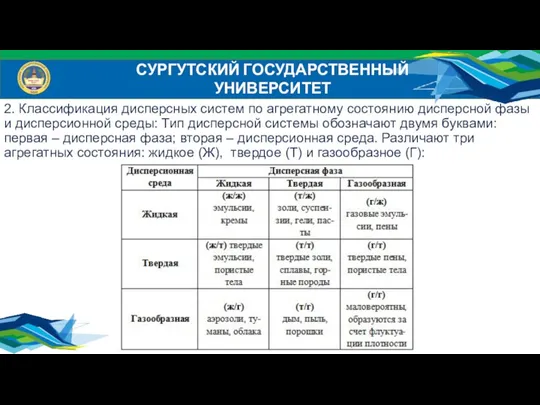
- 7. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ 2. Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды: Тип
- 8. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ 3. По интенсивности межмолекулярных взаимодействий на границе раздела фаз: а) Лиофильные коллоидные системы
- 9. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Получение лиофобных коллоидных систем I. Методы диспергирования (диспергационные методы) – дробление крупных тел
- 10. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ 2. Методы химической конденсации Подбор условий химической конденсации: В результате химической реакции должно
- 11. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Например: Образование золя кремниевой кислоты Na2SiO3 (изб.) + 2 HCl = H2SiO3↓ +
- 12. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Например: Образование золя кремниевой кислоты Na2SiO3 + 2 HCl(изб.) = H2SiO3↓ + 2
- 13. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Правило Фаянса – Панета: Потенциалопределяющими ионами (ПОИ) будут ионы, входящие в состав агрегата
- 14. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ На поверхности твердого тела при контакте с жидкостью самопроизвольно возникает избыточный электрический заряд,
- 15. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Теория Гельмгольца (1879 г) Суть: ДЭС рассматривается как плоский конденсатор, связанный с поверхностью
- 16. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Потенциал φ в такой системе резко падает, а значение поверхностного заряда определяется формулой:
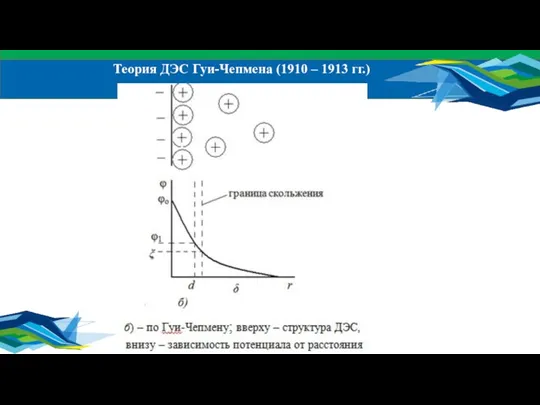
- 17. Теория ДЭС Гуи-Чепмена (1910 – 1913 гг.)
- 18. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ В теории Гуи-Чепмена использовали следующие допущения: Размеры ионов не учитываются, т.е. рассматриваются как
- 19. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Основные положения теории Штерна Ионы, образующие ДЭС имеют конечные размеры; Между ионами и
- 20. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
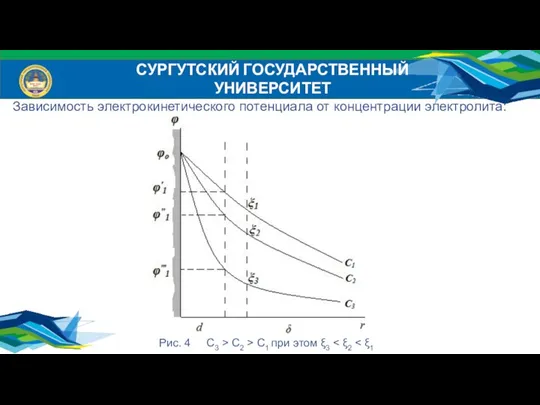
- 21. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Зависимость электрокинетического потенциала от концентрации электролита: Рис. 4 С3 > С2 > С1
- 22. Методы определения электрокинетического ξ потенциала: Электрокинетические; Метод подвижной границы; Микроскопические и ультрамикроскопические методы; Электроосмотические. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ
- 23. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Действие индифферентных электролитов на ДЭС: Индифферентные (безразличные) электролиты – электролиты, не имеющие ионов,
- 24. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 25. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Действие неиндифферентных электролитов на ДЭС: Неиндифферентные электролиты – электролиты, один из ионов которых
- 26. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 27. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 28. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Седиментационная устойчивость – это устойчивость системы по отношению к силе тяжести, т.е. к
- 29. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Процесс слипания частиц дисперсной фазы в более крупные агрегаты с потерей агрегативной устойчивости
- 30. Порог коагуляции - это минимальная концентрация электролита, способная вызывать коагуляцию. Многочисленные исследования показали, что коагулирующим является
- 31. Правило Шульце-Гарди: Коагулирующее действие оказывает ион, имеющий тот же знак заряда, что и противоионы в двойном
- 32. Устойчивость коллоидных систем увеличивается в присутствии молекул ПАВ, полимеров (белков), действие которых характеризуется защитным числом –
- 34. Скачать презентацию



























 Органолептические и визуальные методы идентификация полимера
Органолептические и визуальные методы идентификация полимера 20230315_prezentatsiya_k_uroku_elementy_ivgruppy_glavnoy_podgruppy_
20230315_prezentatsiya_k_uroku_elementy_ivgruppy_glavnoy_podgruppy_ Чистые вещества и смеси
Чистые вещества и смеси Свойства спирта и воды
Свойства спирта и воды 20230305_ammiak
20230305_ammiak Агрегатные состояния веществ. Газовые законы для идеальных и реальных газов
Агрегатные состояния веществ. Газовые законы для идеальных и реальных газов Алюминий. Природные соединения алюминия
Алюминий. Природные соединения алюминия Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов
Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов Химический элемент медь
Химический элемент медь Речовини. Молекули. Атоми
Речовини. Молекули. Атоми Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Коррозия металлов
Коррозия металлов Төменгі фосфориттерден азот – фосфорлы тыңайтқыштар алу технологиясын әзірлеу
Төменгі фосфориттерден азот – фосфорлы тыңайтқыштар алу технологиясын әзірлеу Chemical Formulas and Nomenclature of compounds
Chemical Formulas and Nomenclature of compounds Химическая термодинамика
Химическая термодинамика Характеристика химического элемента Металла на основании его положения в периодической системе Д.И. Менделеева
Характеристика химического элемента Металла на основании его положения в периодической системе Д.И. Менделеева Фосфор и его соединения
Фосфор и его соединения Железо и его свойства
Железо и его свойства Карбон
Карбон Циклоалканы. Строение циклоалканов
Циклоалканы. Строение циклоалканов Спирты
Спирты Химическая связь. 8 класс
Химическая связь. 8 класс Органічна хімія. Теорія хімічної будови. Гомологічні ряди. Алкани
Органічна хімія. Теорія хімічної будови. Гомологічні ряди. Алкани Кислотно-основное титрование
Кислотно-основное титрование Типы химических реакций
Типы химических реакций Химическая кинетика
Химическая кинетика Материаловедение и технологии конструкционных материалов
Материаловедение и технологии конструкционных материалов Общие сведения о гетероциклах
Общие сведения о гетероциклах