Содержание
- 2. Знаходження в природі С 0,14% Карбонатні гірські породи (99%С) Ст. ок. +4 СаСО3 – кальцит у
- 3. Нафта(СхНу), газ(СН4, С2Н6), вугілля, торф, сланці в біосфері(0,01%) 200000 млрд. т. в атмосфері(≈ 0,03% СО2) 2000
- 4. С 2s22p2 С* 2s12p3 вал. = 2 вал. = 4 Ступінь окиснення -4..........0...........+4 Утворює ланцюги, цикли
- 5. Алотропні модифікації карбону Графіт має високу тепло- та електропровідність (як метали) ρ= 2,1÷ 2,3 г/см3 tпл.=
- 6. карбін α-карбін – напівпровідник ρ= 3,2÷ 3,3 г/см3 алмаз Діелектрик (∆Е = 5,49 еВ) Зі значною
- 7. -4 0 +2 +4 Al4C3, Алмаз, СО, НСОOH, СО2, CH4 карбін, HCN Н2СО3 графіт, карбонати, фулерен
- 8. C доволі інертний, тому що сполуки є полімерами і щоб розірвати зв’язки потрібні значні затрати енергії
- 9. КАРБІДИ МЕТАЛІВ s- i p- Ме d - Me Ca+2C→CaC2 Fe3C(цементит), WC, W2C, TiC, Cr3C2,MoC, CaO+3C
- 10. Оксиди СО С + О2 → СО2 ΔН СО2 + С → 2СО ΔН > 0
- 11. Добування в лабораторії О Н С + H2SO4 конц. → CO + H2SO4·H2O ОН (СО майже
- 12. CO + H2O ↛ кислота, основа CO + кислоти ↛ CO + NaOH↛ За звичайних умов
- 13. +2 CO – типовий відновник +2 +4 СО + О2 → СО2 ΔН СО + Сl2
- 14. 4CO +Ni ⇆ Ni(CO)4 карбоніл 5CO + Fe → Fe(CO)5 СО – донор електронів Розкладом карбонілів
- 15. СО2 в промисловості CaCO3 → CaO + CO2 в лабораторії: CaCO3 + 2HCl → CaCl2 +
- 16. CO2 + H2O ⇆ H2CO3 слабка кислота К1 = 1,32·10-4 К2 = 4,68·10-11 Середні солі: Na2CO3
- 17. Розчинними є лише карбонати лужних металів(крім Li2CO3) та амонію. Розчинні солі у водних розчинах гідролізують CaCl2
- 18. Cr2(CO3)3 Al2(CO3)3 2AlCl3 + 3Na2CO3 + 3Н2О → Al(ОН)3↓ + 3CO2↑ +6NaCl 3+ 2- 2Al +
- 19. CaCO3 + CO2 + Н2О → Ca(HCO3)2 Н2О Ca(HCO3)2 → CaCO3 + H2СO3 СO2 Ca(HCO3)2 +
- 20. +4 CO2 – найвищий ступінь окиснення, але окисні властивості виражені дуже слабо +4 0 Mg +
- 21. Сполуки з сульфуром СН4 + 4S → CS2 + 2H2S C + 2S → CS2 сірковуглець
- 22. CS2 – безбарвна рідина, tкип.= 46,2 оС молекула лінійна, неполярна CS2 – кислотний сульфід CS2 +
- 23. H2CS3 → H2S + CS2 найстійкіша із тіокислот H2CS3 + 2H2O → CO2 + 3H2S(повільно) CS2
- 24. СПОЛУКИ З ГАЛОГЕНАМИ Фреони СF4 (tкип.= -128 оС) та СF2Сl2 вони мають значну теплоту випаровування за
- 25. CO + Cl2 → COCl2 CH4 + 4Cl2→ CCl4 + 4HCl CCl4, COCl2 – галогеноангідриди CCl4
- 26. СПОЛУКИ З НІТРОГЕНОМ C2N2 2AgCN → 2Ag + C2N2 CuSO4 + 4KCN → 2CuCN↓ + C2N2
- 27. sp – гібридизація C2N2 + H2 → 2HCN аналогічно Cl2 + H2 → 2HCl Cl2 +
- 28. HCN NH3 + CO → HCN + H2O 2CH4 +3O2 + 2NH3 → 2HCN +6H2O HCN
- 29. Промислові способи добування солей: K2CO3 + C + 2NH3 → 2KCN + 3H2O 2NaNH2 + 2C
- 30. CN- - має відновні властивості 2KCN + O2 → 2KCNO HOCN Кд≈10-4 “гримуча”
- 31. HNСO + H2O → CO2 + NH3 NH3 + HNСO → CO(NH2)2 NH4OCN → CO(NH2)2 ціанат
- 33. Скачать презентацию
 Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства
Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства Тірі ағзада жүретін процесстер – физика-химиялық интерпретация
Тірі ағзада жүретін процесстер – физика-химиялық интерпретация Классы неорганических веществ. Лекция №2
Классы неорганических веществ. Лекция №2 Индикаторы. Круговорот воды в природе. Загрязнение природных вод. Охрана и очистка природных вод
Индикаторы. Круговорот воды в природе. Загрязнение природных вод. Охрана и очистка природных вод Электролиты и неэлектролиты. Электролитическая диссоциация веществ в водных растворах
Электролиты и неэлектролиты. Электролитическая диссоциация веществ в водных растворах Строение электронных оболочек атомов химических элементов
Строение электронных оболочек атомов химических элементов Железо и его соединения
Железо и его соединения Вклад ученых-химиков в победу в Великой Отечественной войне
Вклад ученых-химиков в победу в Великой Отечественной войне Лужні метали
Лужні метали Кислоты
Кислоты Методы количественного определения металлических ядов в минерализате (деструктате)
Методы количественного определения металлических ядов в минерализате (деструктате) Типы химических реакций
Типы химических реакций Аналитическая химия
Аналитическая химия Методы получения основных классов неорганических соединений
Методы получения основных классов неорганических соединений Характеристика азота и фосфора. Физические и химические свойства
Характеристика азота и фосфора. Физические и химические свойства Кобальт. Химический элемент
Кобальт. Химический элемент Строение атома углерода. Валентные состояния атома углерода
Строение атома углерода. Валентные состояния атома углерода 10 самых смертельно опасных камней и минералов
10 самых смертельно опасных камней и минералов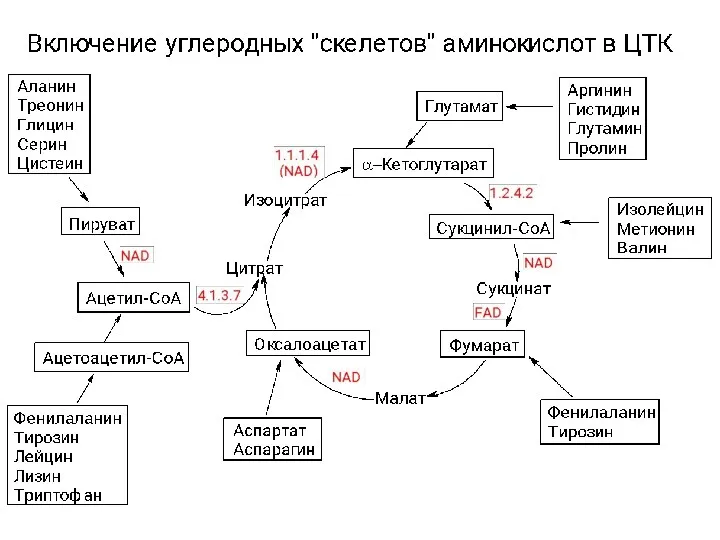 Катаболизм аминокислот
Катаболизм аминокислот Ионный обмен. Хроматография
Ионный обмен. Хроматография Классификация химических реакций в неорганической химии
Классификация химических реакций в неорганической химии Диффузия вокруг нас
Диффузия вокруг нас Распределительная хроматография
Распределительная хроматография Типы химических реакций
Типы химических реакций Распространение пламени в газах
Распространение пламени в газах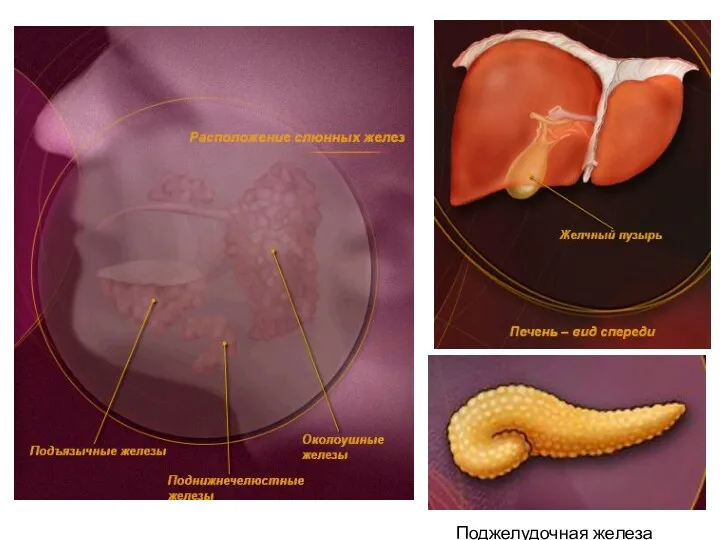 Катализаторы. Ферменты
Катализаторы. Ферменты алканы 170
алканы 170 Такой разный песок
Такой разный песок