Содержание
- 2. «Характеристика азота и фосфора. Физические и химические свойства азота».
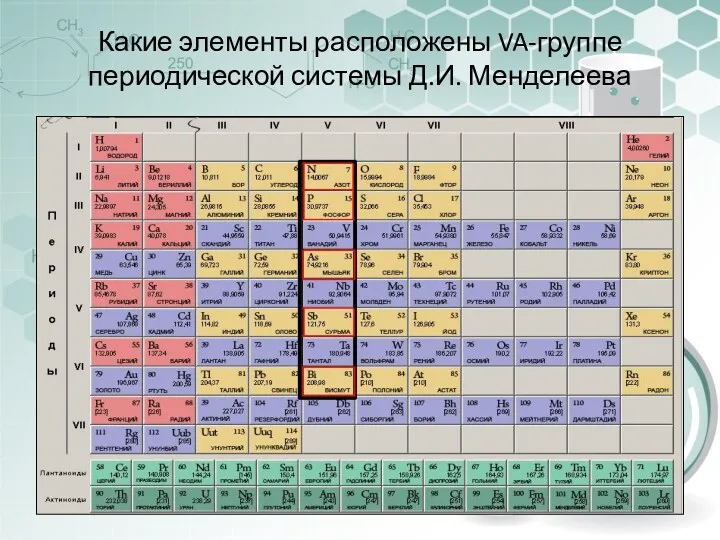
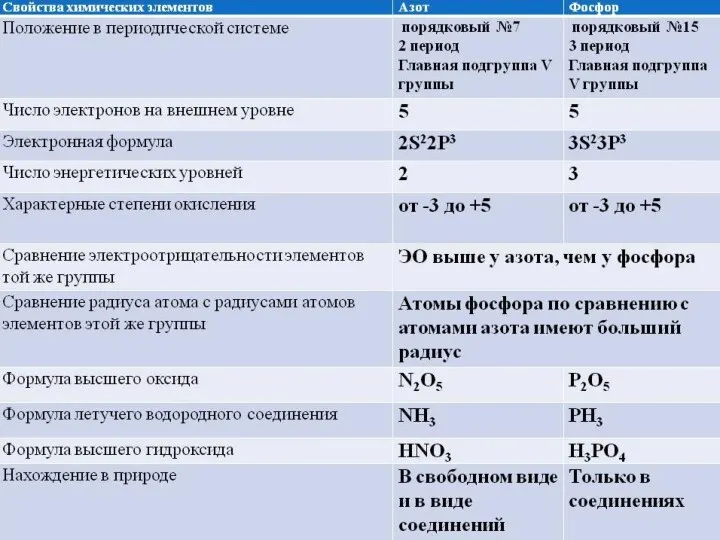
- 4. Какие элементы расположены VA-группе периодической системы Д.И. Менделеева
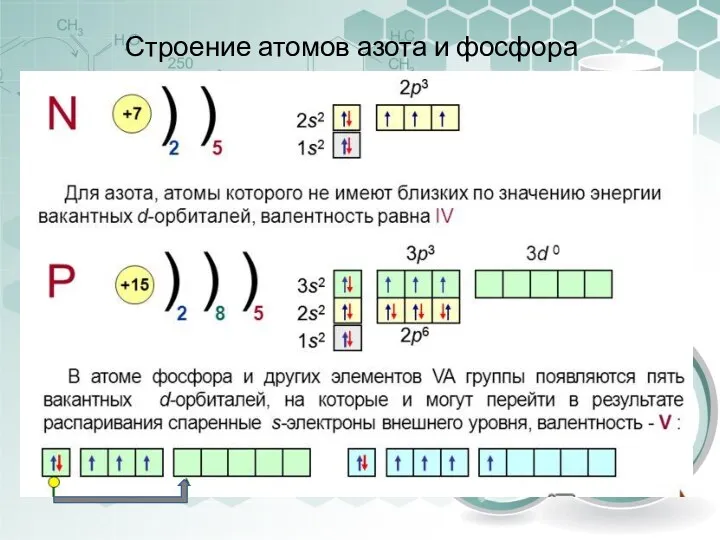
- 5. Строение атомов азота и фосфора
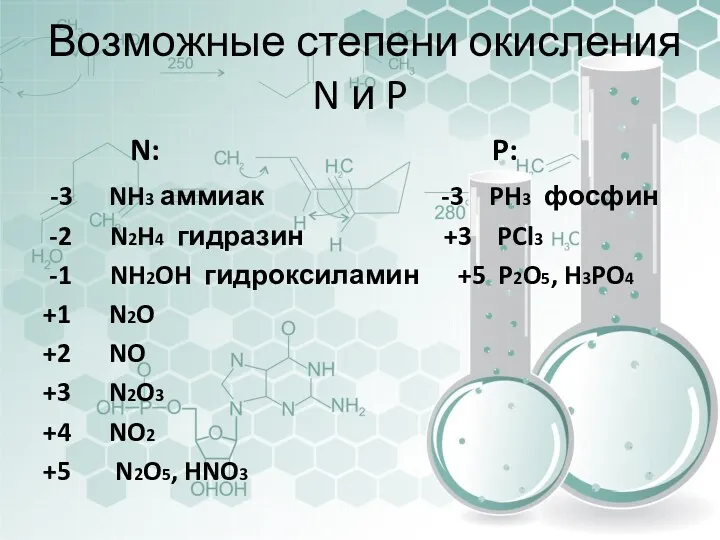
- 6. Возможные степени окисления N и P N: P: -3 NH3 аммиак -3 PH3 фосфин -2 N2H4
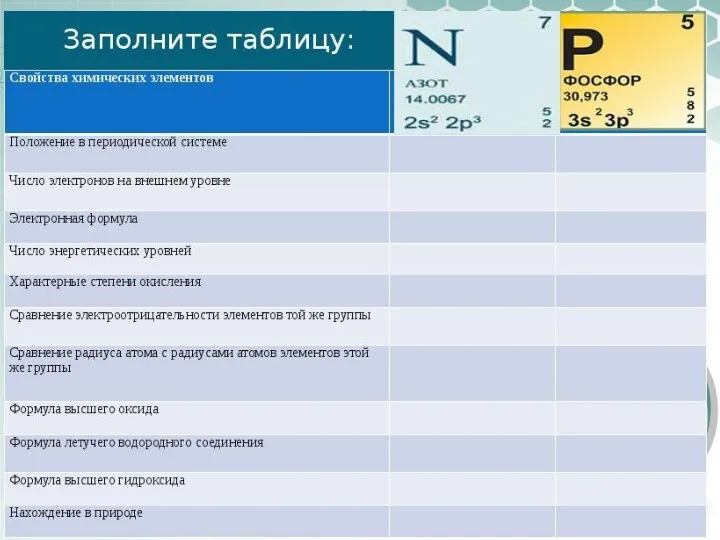
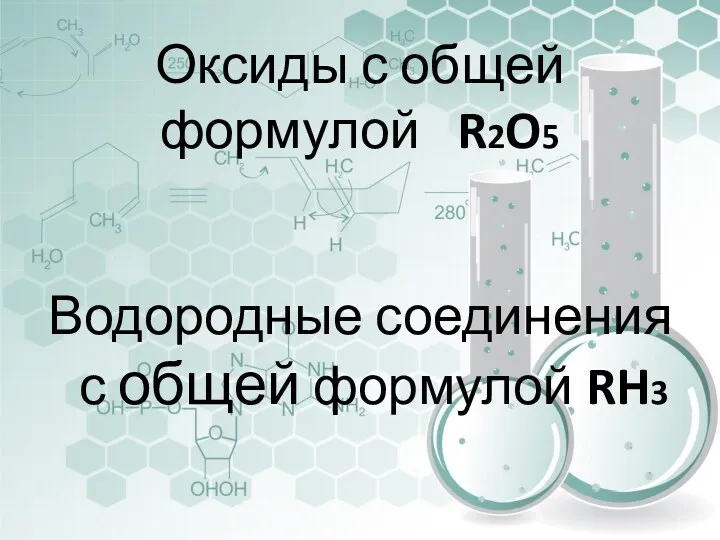
- 7. Оксиды с общей формулой R2O5 Водородные соединения с общей формулой RH3
- 8. Составьте формулы соединений азота как окислителя и как восстановителя. КN ВaN AlN HN NO(I) NO(II) NO(III)
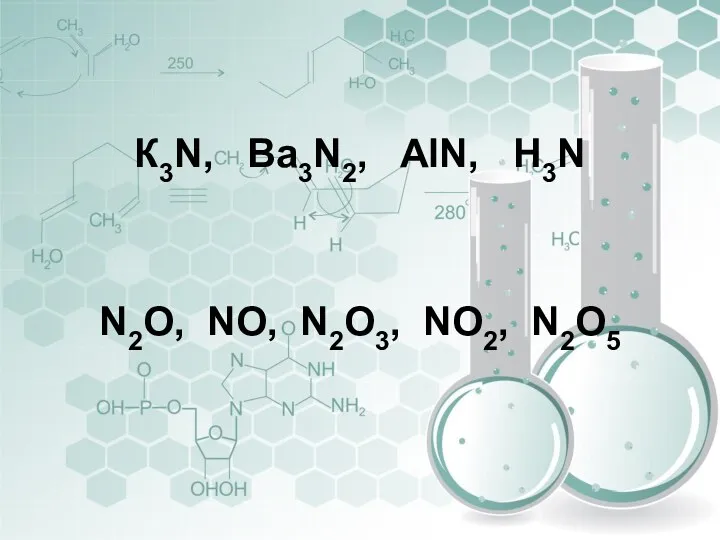
- 9. К3N, Вa3N2, AlN, Н3N N2O, NO, N2O3, NO2, N2O5
- 11. Азот — один из самых распространённых элементов на Земле. Вне пределов Земли азот обнаружен в газовых
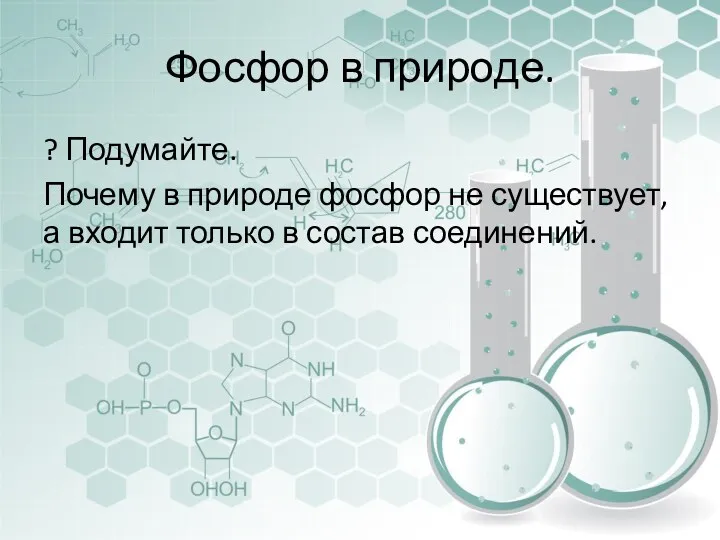
- 12. Фосфор в природе. ? Подумайте. Почему в природе фосфор не существует, а входит только в состав
- 13. Фосфор в природе Фосфор в природе встречается в основном в виде фосфатов. Так, фосфат кальция Са3(PO4)2
- 15. История открытия азота В 1772 году английский химик Генри Кавендиш – «удушливый воздух» В 1772 году
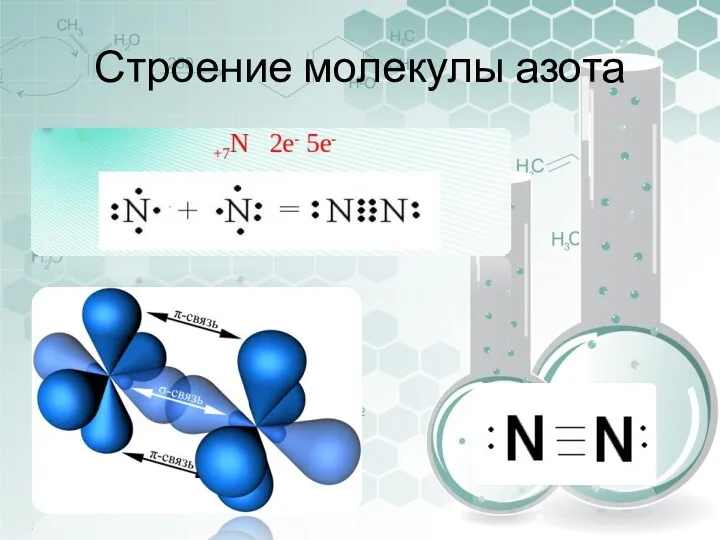
- 16. Строение молекулы азота
- 17. Физические свойства азота
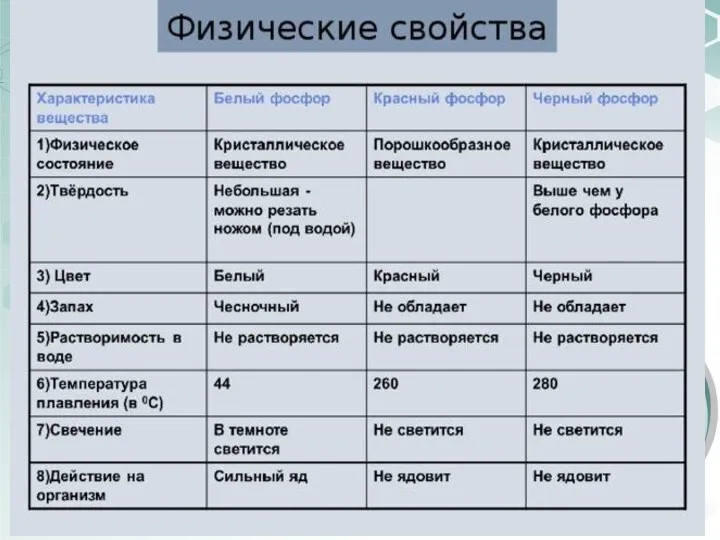
- 18. В свободном состоянии фосфор образует несколько аллотропных модификаций, которые называются белым, красным и черным фосфором. Фосфор
- 19. В простейшей молекуле Р4 каждый из четырех атомов фосфора связан ковалентной связью с тремя остальными. Из
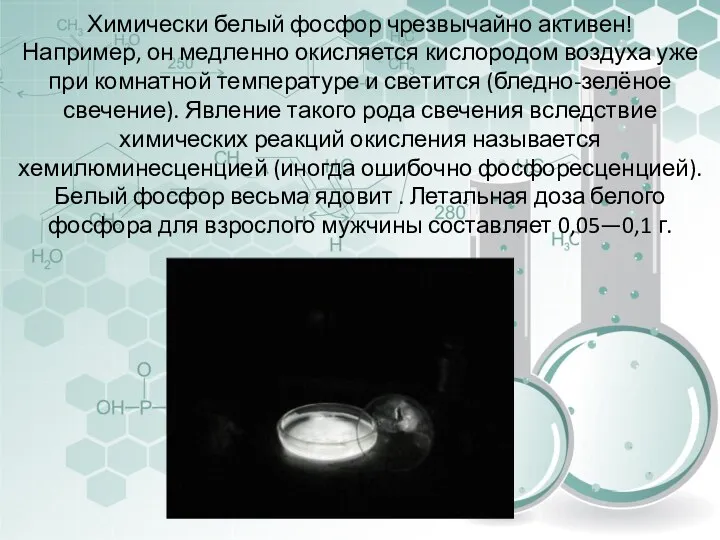
- 20. Химически белый фосфор чрезвычайно активен! Например, он медленно окисляется кислородом воздуха уже при комнатной температуре и
- 21. Красный фосфор имеет атомную полимерную структуру, в которой каждый атом фосфора связан с тремя другими атомами
- 22. При нагревании под давлением примерно в 1200 раз большим, чем атмосферное давление, белый фосфор переходит в
- 23. В 1830 году французский химик Шарль Сориа изобрёл фосфорные спички, состоявшие из смеси бертолетовой соли, белого
- 25. Получение азота из воздуха: при испарении жидкого воздуха азот улетучивается первым (tкип = - 196оС, а
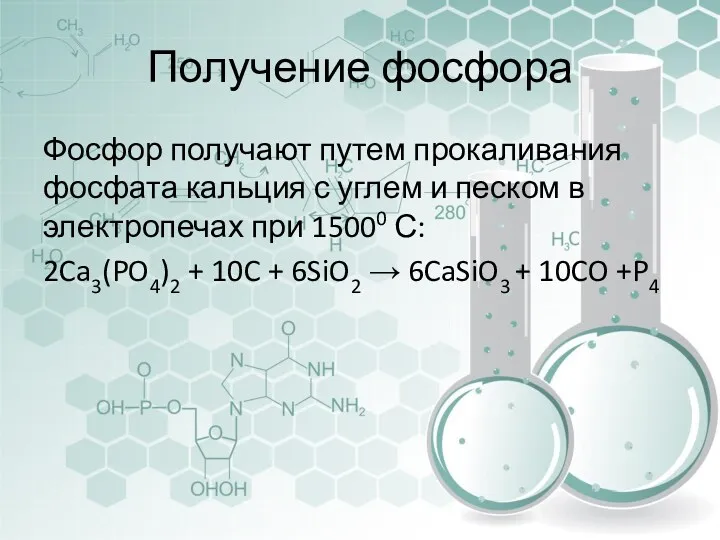
- 26. Получение фосфора Фосфор получают путем прокаливания фосфата кальция с углем и песком в электропечах при 15000
- 27. Химические свойства азота
- 31. Применение соединений азота
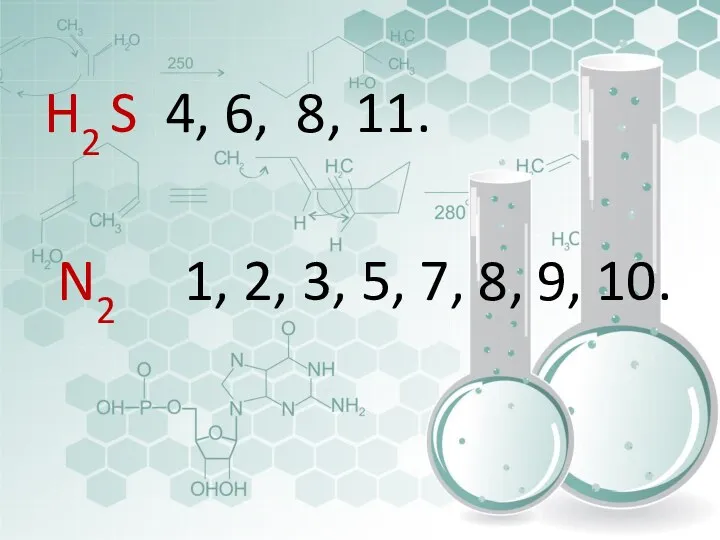
- 32. Выпишите в две строчки ответы ,относящиеся к сероводороду или азоту Газ без цвета , вкуса и
- 33. H2 S 4, 6, 8, 11. N2 1, 2, 3, 5, 7, 8, 9, 10.
- 34. Аргументы в пользу каждой версии: Азот – «безжизненный»; 2. Азот – главный элемент жизни.
- 36. Скачать презентацию



















 Періодична система хімічних елементів. Хімія. 8 клас
Періодична система хімічних елементів. Хімія. 8 клас Теория электролитической диссоциации
Теория электролитической диссоциации Стали и чугуны. Классификация и маркировка
Стали и чугуны. Классификация и маркировка Алкадиены. Каучуки
Алкадиены. Каучуки Углерод. Аллотропные модификации
Углерод. Аллотропные модификации Синтез на основі бензену
Синтез на основі бензену Дисперсные системы. (Лекция 6)
Дисперсные системы. (Лекция 6) Ретросинтез Wickerol A
Ретросинтез Wickerol A Дистилляция и ректификация
Дистилляция и ректификация Гидролиз солей
Гидролиз солей Полипропилен
Полипропилен Күрделі эфирлер
Күрделі эфирлер Гибридизация. Формы электронных облаков
Гибридизация. Формы электронных облаков Методика преподавания химии
Методика преподавания химии Одноатомные спирты
Одноатомные спирты Нефть и газ
Нефть и газ Crystal defects
Crystal defects Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Кислотно-основные равновесия в водном растворе. Буферные растворы. (Лекция 3)
Кислотно-основные равновесия в водном растворе. Буферные растворы. (Лекция 3)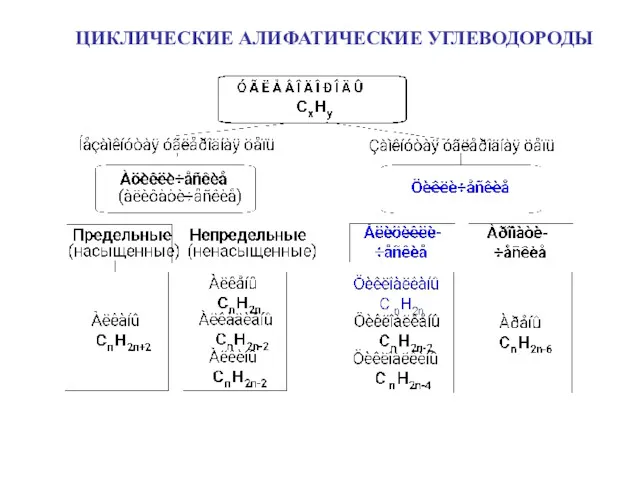 Циклические алифатические углеводороды
Циклические алифатические углеводороды Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Реакции ионного обмена
Реакции ионного обмена Натуральные волокна
Натуральные волокна Непредельные углеводороды. Этилен и его гомологи
Непредельные углеводороды. Этилен и его гомологи Термохимия. Расчет тепловых эффектов химических реакций
Термохимия. Расчет тепловых эффектов химических реакций Растворы электролитов. Буферные растворы. Лекция 4
Растворы электролитов. Буферные растворы. Лекция 4 Электрохимическая система
Электрохимическая система Оксиды. Физические свойства
Оксиды. Физические свойства