Содержание
- 2. Алкадиены. Каучуки
- 3. План изучения класса веществ 1. Состав и строение 2. Номенклатура и изомерия 3. Физические свойства 4.
- 4. 1. Состав и строение Алкадиены – ациклические непредельные УВ, содержащие в молекуле две двойные связи между
- 5. Три вида алкадиенов: 1) с кумулированным расположением двойных связей СН2=С=СН–СН3 2) с сопряженным расположением двойных связей
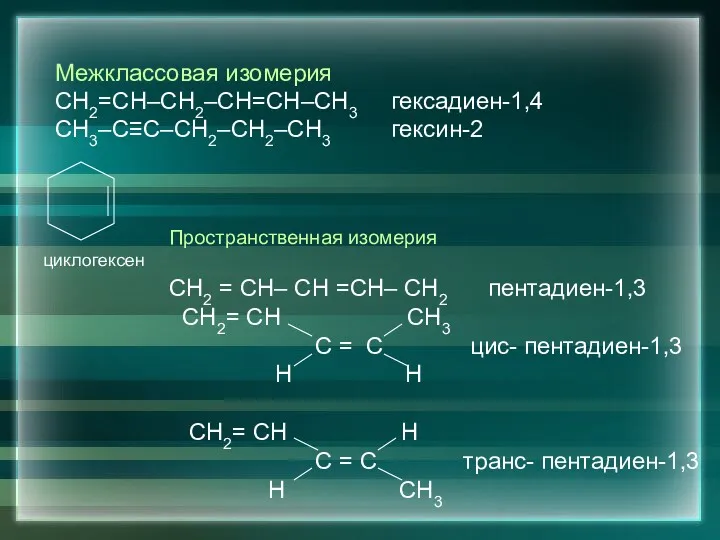
- 6. 2. Изомерия Изомерия углеродного скелета: СН2=СН–СН2–СН=СН–СН3 гексадиен-1,4 СН2=СН–СН–СН=СН2 3-метилпентадиен-1,4 ⎮ СН3 Изомерия положения кратных связей СН2=СН–СН=СН–СН3
- 7. Межклассовая изомерия СН2=СН–СН2–СН=СН–СН3 гексадиен-1,4 СН3–С≡С–СН2–СН2–СН3 гексин-2 циклогексен
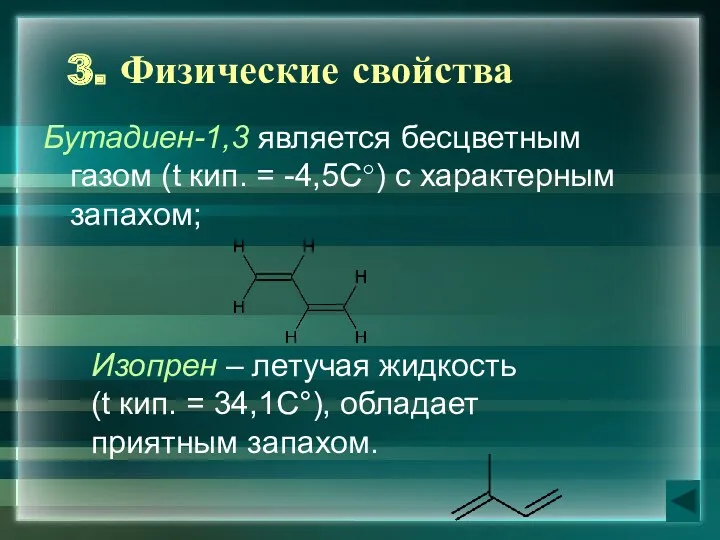
- 8. 3. Физические свойства Бутадиен-1,3 является бесцветным газом (t кип. = -4,5С°) с характерным запахом; Изопрен –
- 9. 4. Химические свойства 1,2 присоединение: СН2=СН –СН =СН2 + Сl2 → → СН2Cl – СНCl –
- 10. Реакции гидрирования 1,2 присоединение: СН2=СН–СН =СН2+ Н2 → → СН2–СН2–СН=СН2 →Н2 → СН3–СН2–СН2–СН3 бутан 1,4 присоединение:
- 11. Проверим себя СН2=СН–СН=СН2 + HBr → → СН3–СНBr–СН=СН2 3-бромбутен-1 (1,2 присоединение) СН2=СН–СН=СН2 + HBr → →
- 12. Реакции полимеризации nСН2=СН–СН=СН2 → (–СН2–СН=СН–СН2–)n бутадиен-1,3 бутадиеновый каучук nСН2=С–СН=СН2 → (–СН2– С = СН –СН2–) n
- 13. Свойства синтетических каучуков
- 14. Знакомство индейцев с каучуком
- 15. Вулканизация Вулканизация —процесс взаимодействия каучуков с вулканизующим агентом (сера, пероксиды, оксиды металлов), при котором происходит сшивание
- 16. История изобретения резины
- 17. 5. Способы получения Дегидрирование: С4Н10 600˚С, Al2O3, Cr2O3 СН2=СН–СН=СН2 + 2Н2 бутадиен-1,3 СН3–СH–СН2–СН3 t, Al2O3, Cr2O3
- 18. Дегидратация и дегидрирование спиртов (метод Лебедева): С2Н5ОН 400-500 °С, Al2O3, ZnO СН2=СН–СН=СН2+ +2Н2O + Н2 Способы
- 19. Свойства и применение резины
- 20. Осуществите цепочку превращений С2Н6→С2Н5Cl→С4Н10→С4Н6 →Каt, t → бутадиеновый каучук
- 22. Скачать презентацию

















 ЛРС и производящие растения, содержащие полисахариды
ЛРС и производящие растения, содержащие полисахариды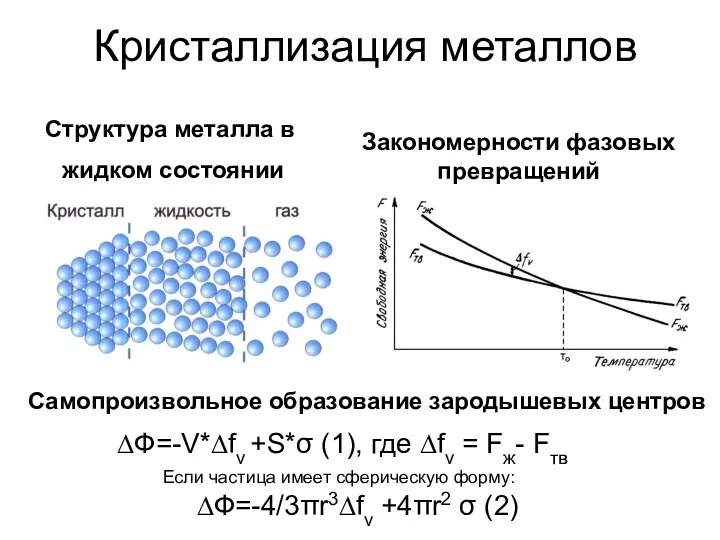 Закономерности фазовых превращений
Закономерности фазовых превращений Металлы. Распространённость металлов в земной коре
Металлы. Распространённость металлов в земной коре Физические методы стабилизации масел
Физические методы стабилизации масел Металлы. Металлы главной подгруппы
Металлы. Металлы главной подгруппы Природные источники углеводородов
Природные источники углеводородов Азотная кислота
Азотная кислота Соли, их классификация и свойства
Соли, их классификация и свойства Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ
Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ Электролитическая диссоциация
Электролитическая диссоциация Задачи и методы количественного анализа. Кислотно-основное титрование
Задачи и методы количественного анализа. Кислотно-основное титрование Экстрагирование в химической промышленности
Экстрагирование в химической промышленности Водородные соединения неметаллов. Выходное тестирование
Водородные соединения неметаллов. Выходное тестирование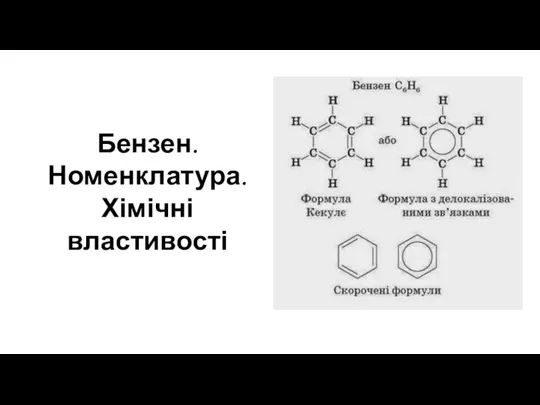 Бензен. Номенклатура. Хімічні властивості
Бензен. Номенклатура. Хімічні властивості Щелочные металлы и их соединения. 9 класс
Щелочные металлы и их соединения. 9 класс Соли. Классификация. Физические и химические свойства. Получение и применение солей
Соли. Классификация. Физические и химические свойства. Получение и применение солей Тяжелые металлы. Загрязнение токсичными металлами окружающей среды
Тяжелые металлы. Загрязнение токсичными металлами окружающей среды Природный газ
Природный газ Изотопная геохимия
Изотопная геохимия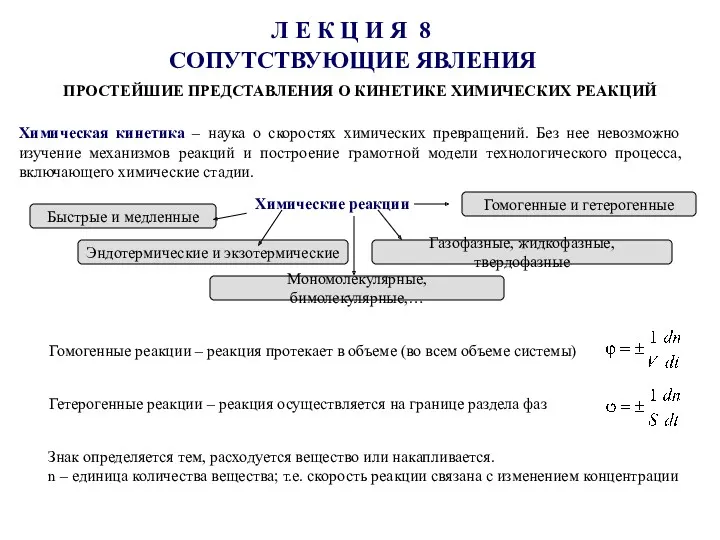 Простейшие представления о кинетике химических реакций
Простейшие представления о кинетике химических реакций Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Алюминий. Строение и свойства атома
Алюминий. Строение и свойства атома Природные источники углеводородов, их переработка, применение и экологические проблемы
Природные источники углеводородов, их переработка, применение и экологические проблемы Основания. Классификация оснований
Основания. Классификация оснований Общие свойства металлов
Общие свойства металлов Радиофармацевтическая химия
Радиофармацевтическая химия Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Алкины. Ацетиленовые углеводороды
Алкины. Ацетиленовые углеводороды