Содержание
- 2. Основания – это сложные вещества, состоящие из атома металла и одной или нескольких гидроксогрупп.
- 3. Состав оснований: Назовите составные части оснований. Ме(ОН)х Валентность гидроксогруппы (ОН) – I Количество гидроксогрупп определяется валентностью
- 4. Основания NaOH – гидроксид натрия Ca(OH)2 – гидроксид кальция Fe(OH)3 – гидроксид железа (III) Cи(OH)2 –
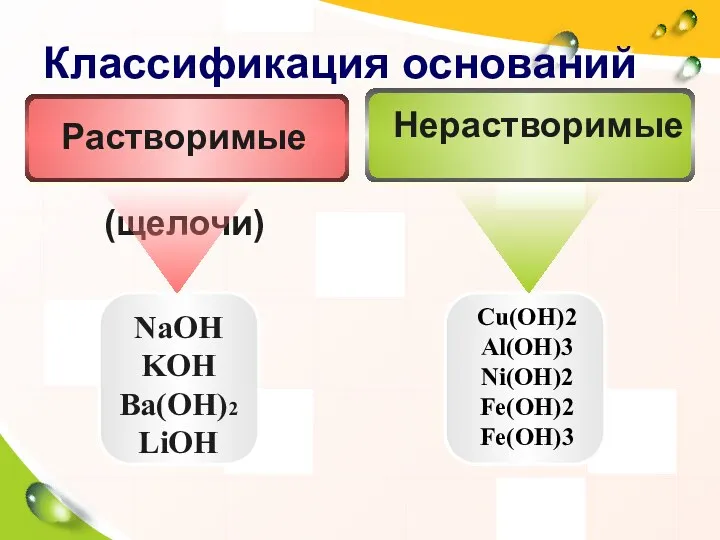
- 5. Классификация оснований NaOH KOH Ba(OH)2 LiOH Cu(OH)2 Al(OH)3 Ni(OH)2 Fe(OH)2 Fe(OH)3 Нерастворимые Растворимые (щелочи)
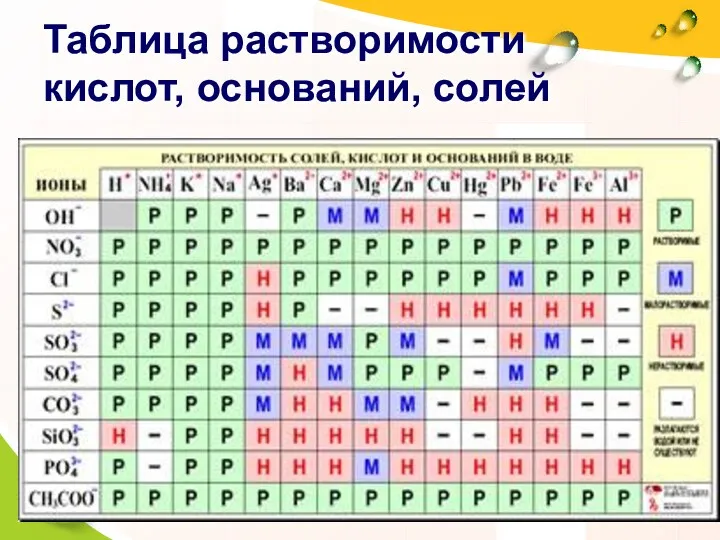
- 6. Таблица растворимости кислот, оснований, солей
- 7. По какому признаку основания разделены на группы? NaOH KOH LiOH СsOH Cu(OH)2 Ba(OH)2 Pb(OH)2 Fe(OH)2 Al(OH)3
- 8. Однокислотные NaOH, KOH Двухкислотные Pb(OH)2, Fe(OH)2 Трехкислотные Al(OH)3 Классификация оснований по числу гидроксогрупп. Основания
- 9. Физические свойства оснований Агрегатное состояние: Все твердые вещества Цвет кислот: Белого – КОН, Голубого - Cu(OH)2
- 10. Химические свойства нерастворимых оснований. 1). Разлагаются при нагревании. 2). Взаимодействуют с кислотами (реакция нейтрализации).
- 11. Химические свойства щелочей. 1). Изменяют окраску индикаторов. Взаимодействуют с: 2). кислотами (реакция нейтрализации), 3). кислотными оксидами,
- 12. ПРАВИЛА БЕЗОПАСНОСТИ Едкое вещество—щелочь! Разрушает и раздражает кожу, слизистые оболочки. Попавшие на кожу капли раствора щелочи
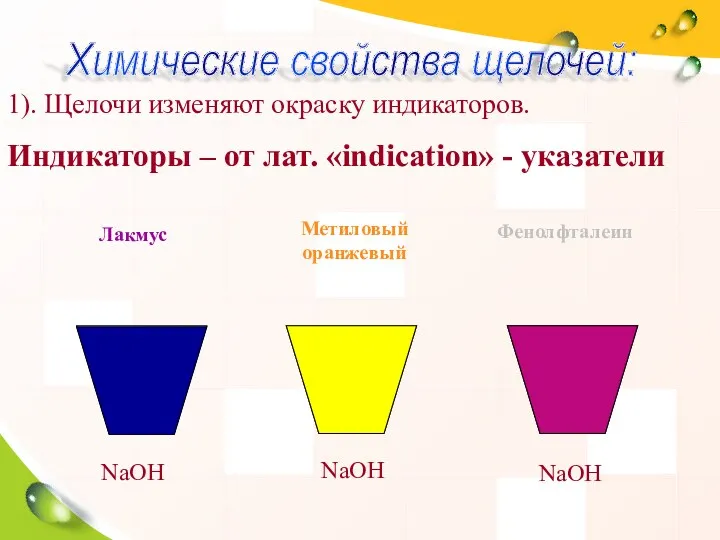
- 13. 1). Щелочи изменяют окраску индикаторов. Индикаторы – от лат. «indication» - указатели NaOH NaOH NaOH Лакмус
- 14. Щелочь + кислота : Ва(ОН)2 + 2НСl = ВаСl2 + 2Н2О хлорид бария Химические свойства щелочей:
- 16. Скачать презентацию










 Углекислый газ
Углекислый газ Скорость химических реакций
Скорость химических реакций Гетерогенные процессы и равновесия
Гетерогенные процессы и равновесия Нефтепродукты. Продукты переработки нефти
Нефтепродукты. Продукты переработки нефти Дисперсные системы: получение и свойства
Дисперсные системы: получение и свойства Мыло. Его состав и моющее действие. Синтетические моющие средства
Мыло. Его состав и моющее действие. Синтетические моющие средства Теплові прояви механічної, електричної та хімічної енергії
Теплові прояви механічної, електричної та хімічної енергії Химическая кинетика. Закон действующих масс для скорости реакции
Химическая кинетика. Закон действующих масс для скорости реакции Целевой и содержательный компоненты процесса обучения химии
Целевой и содержательный компоненты процесса обучения химии Химическая связь. Лекция 2-3
Химическая связь. Лекция 2-3 Гидроксид лития ( LiOH)
Гидроксид лития ( LiOH) Аммиак. Соли аммония
Аммиак. Соли аммония Хімічні та фізичні явища
Хімічні та фізичні явища Газообразное состояние вещества
Газообразное состояние вещества Химические средства гигиены и косметики
Химические средства гигиены и косметики Задачи
Задачи Metode electrochimice. Generalităţi
Metode electrochimice. Generalităţi Қалдық мөлшерлер
Қалдық мөлшерлер Соединения железа Fe+2 и Fe+3
Соединения железа Fe+2 и Fe+3 Классификация неорганических веществ
Классификация неорганических веществ Программа HyperChem
Программа HyperChem Техника безопасности на уроках химии
Техника безопасности на уроках химии Главная подгруппа VIII группы периодической системы. Девятнадцатая лекция
Главная подгруппа VIII группы периодической системы. Девятнадцатая лекция Кислоты. Индикаторы
Кислоты. Индикаторы Фосфор и его соединения
Фосфор и его соединения Періодична система хімічних елементів. Хімія. 8 клас
Періодична система хімічних елементів. Хімія. 8 клас Игра - викторина
Игра - викторина Загадки минералов. 7 класс
Загадки минералов. 7 класс