Содержание
- 2. 1. Гетерогенные процессы и равновесия (определение, пример). 2. Растворимость, единица количественного выражения растворимости (массовая растворимость вещества
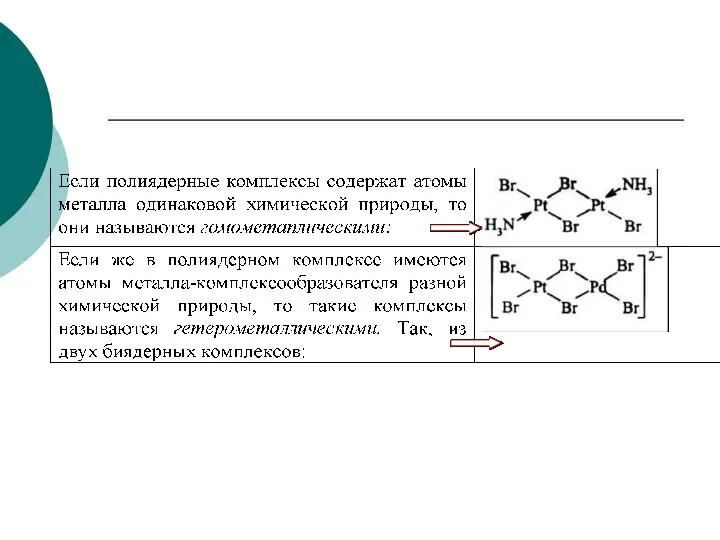
- 3. Раздел 2. Основные учебно-целевые вопросы: Лигандообменные равновесия и процессы Комплексные соединения - КС (определение, примеры). Структура
- 4. Гетерогенные равновесия в системе осадок- насыщенный раствор малорастворимого электролита Системы Основные понятия Гомогенная- это система, состоящая
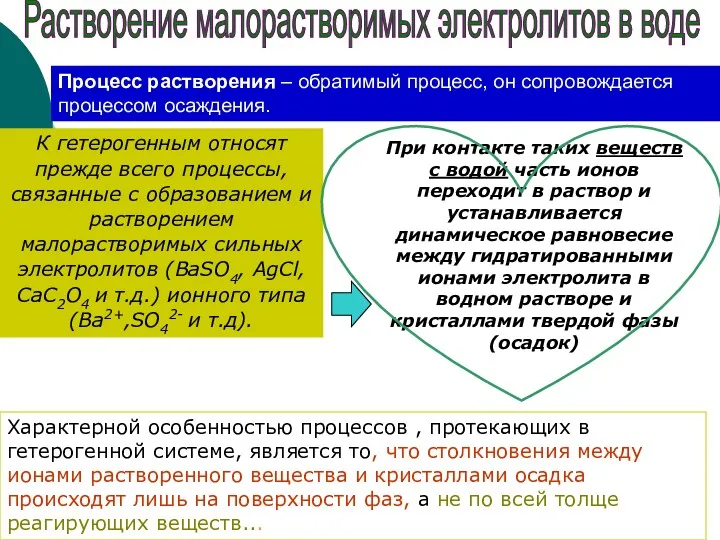
- 5. К гетерогенным относят прежде всего процессы, связанные с образованием и растворением малорастворимых сильных электролитов (ВaSO4, AgCl,
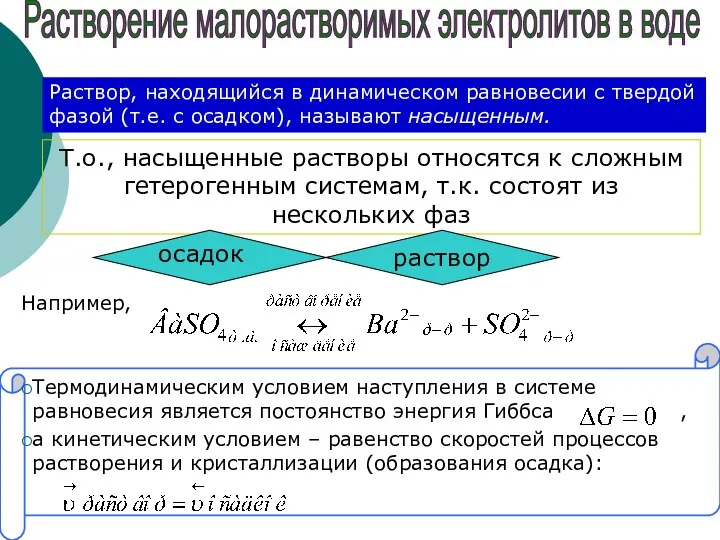
- 6. Т.о., насыщенные растворы относятся к сложным гетерогенным системам, т.к. состоят из нескольких фаз раствор осадок Растворение
- 7. Молярная растворимость - S (т.е. концентрация ионов в насыщенном растворе) Под растворимостью обычно подразумевают концентрацию насыщенного
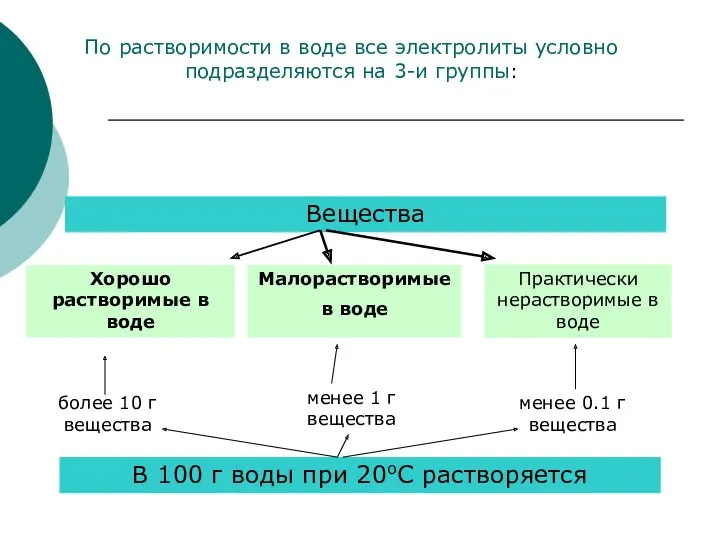
- 8. Вещества Хорошо растворимые в воде Малорастворимые в воде Практически нерастворимые в воде В 100 г воды
- 9. КS малорастворимого сильного электролита — это величина, равная произведению равновесных активностей (или равновесных концентраций) ионов данного
- 10. Константа растворимости КS В общем случае для малорастворимого электролита константа растворимости Ks определяется стехиометрическим произведением концентраций
- 11. КS Безразмерная величина. Применимо к сильным электролитам, у которых молярная растворимость S Значения констант растворимости малорастворимых
- 12. Взаимосвязь Кs и растворимости S: Растворимость малорастворимого электролита KtnAnm (S, моль/л), т.е. молярность его насыщенного раствора,
- 13. Справочная величина Взаимосвязь Кs и растворимости S: Задача 1.
- 14. Условия смещения гетерогенного равновесия В соответствии с уравнением изотермы Вант-Гоффа: возможность смещения равновесия, т.е. образование или
- 15. Пс > Ks – соответствует образованию осадка (перенасыщенный раствор); Пс Пс = Ks система находится в
- 16. Растворимость малорастворимых электролитов: а) понижается при введении в их раствор каких-либо сильных электролитов с одноименным ионом,
- 17. Влияние различных факторов на полноту осааждения осадков и их растворение Различные электролиты, прилитые в одинаковых количествах,
- 18. 1. Осаждение будет тем полнее, чем менее растворимо соединение, в виде которого осаждается данный ион. 2.
- 19. Правило константы растворимости применяется при решении противоположной задачи, т. е. при переведении малорастворимых осадков в раствор
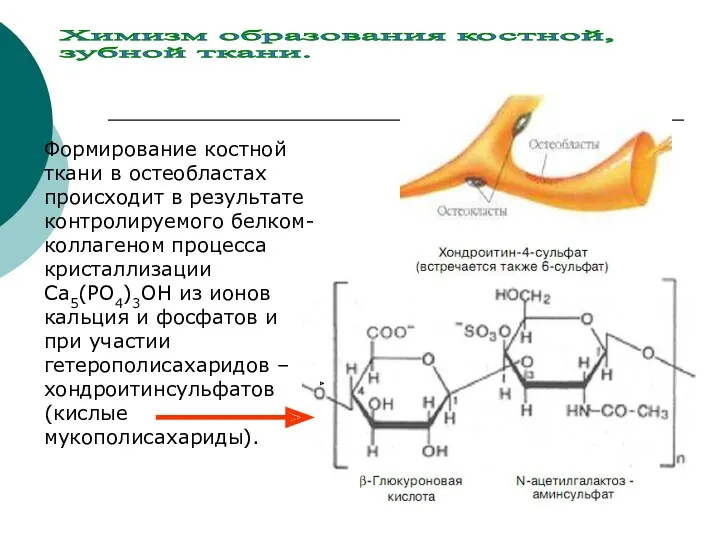
- 20. Химизм образования костной, зубной ткани Костная ткань –особый вид соединительной ткани и она является главной составной
- 21. Химизм образования костной, зубной ткани. Процесс минерализации можно выразить упрощенно суммарными уравнениями: Или пентакальцийтрифосфатгидроксид. Образованию гидроксиапатита
- 22. Формирование костной ткани в остеобластах происходит в результате контролируемого белком- коллагеном процесса кристаллизации Са5(РО4)3ОН из ионов
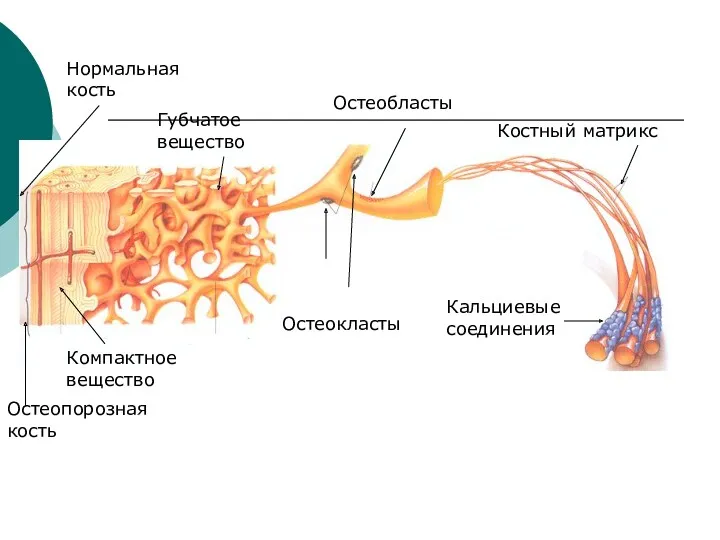
- 23. Кальциевые соединения Костный матрикс Остеокласты Остеобласты Нормальная кость Остеопорозная кость Компактное вещество Губчатое вещество
- 24. Химизм растворения костной и зубной ткани. При небольшом повышении содержания протонов кость начинает растворяться, отдавая вначале
- 25. Минерализация и деминерализации малорастворимых фосфатов кальция согласно принципу Ле Шателье
- 26. Изоморфизм Изоморфизмом (И) - замещение ионов в узлах кристаллической решетки другими ионами, имеющими сходные кристаллохимические характеристики.
- 27. Изоморфизм Отрицательный изоморфизм – замещение ионов кальция в гидроксиапатите на ионы Sr2+(стронциевый рахит- ломкость костей) и
- 28. Механизм кальцификации и функционирования кальциевого буфера Ежедневно из костей скелета уходит и возвращается в него 700-800
- 29. Основными регуляторами кальций-фосфорного обмена в организме человека являются витамин D и гормоны паратирин и кальцитонин. Витамин
- 30. Гетерогенные процессы в организме.
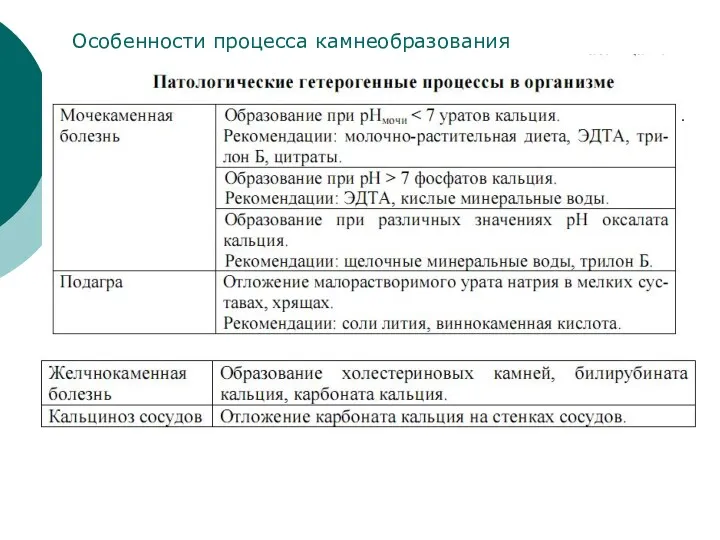
- 31. Особенности процесса камнеобразования
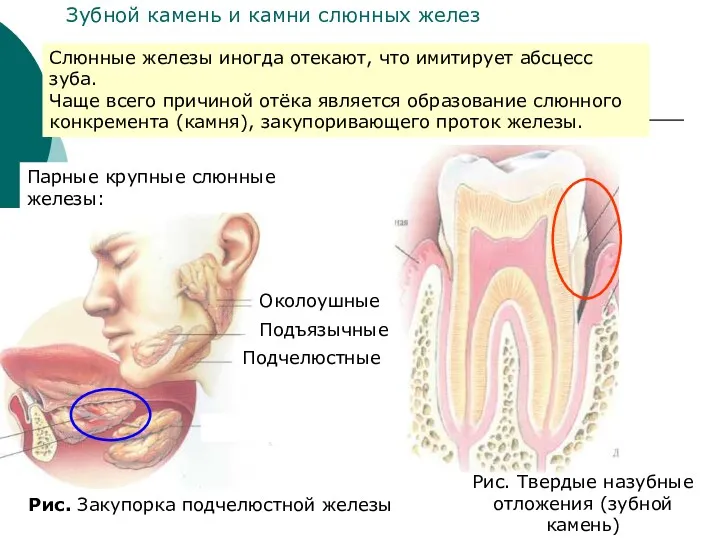
- 32. Парные крупные слюнные железы: Околоушные Подъязычные Подчелюстные Рис. Закупорка подчелюстной железы Слюнные железы иногда отекают, что
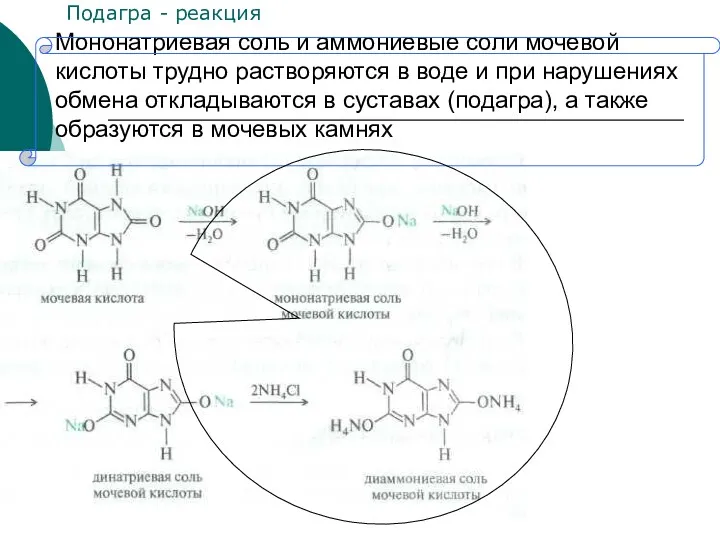
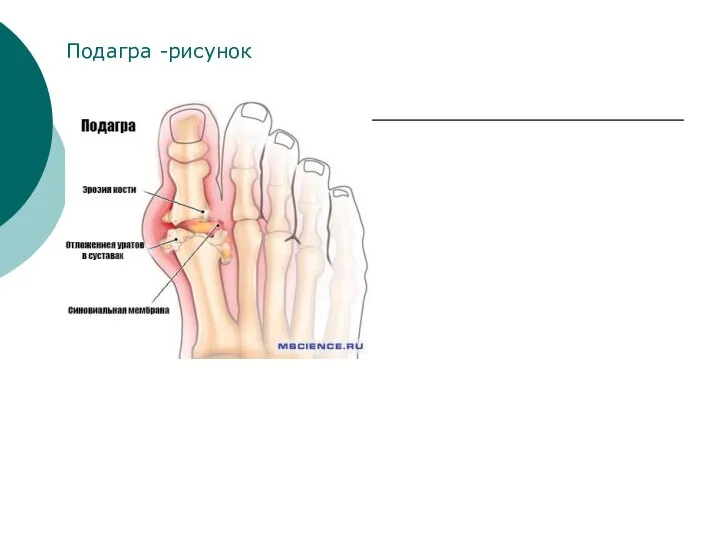
- 33. Мононатриевая соль и аммониевые соли мочевой кислоты трудно растворяются в воде и при нарушениях обмена откладываются
- 34. Подагра -рисунок
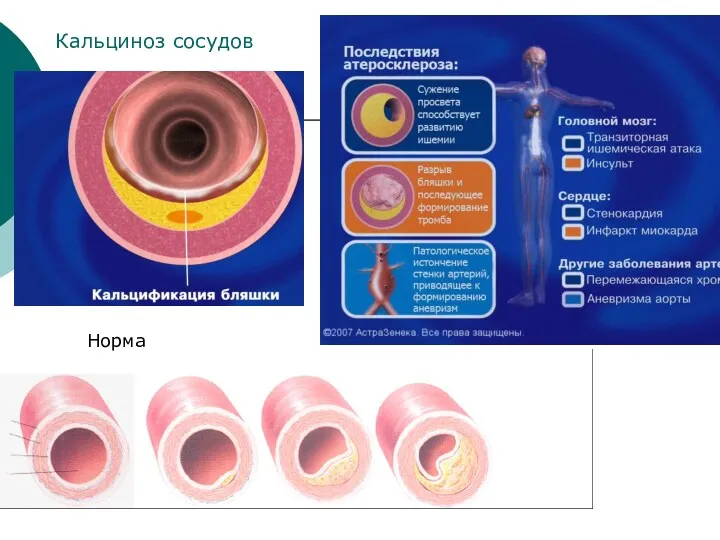
- 35. Норма Кальциноз сосудов
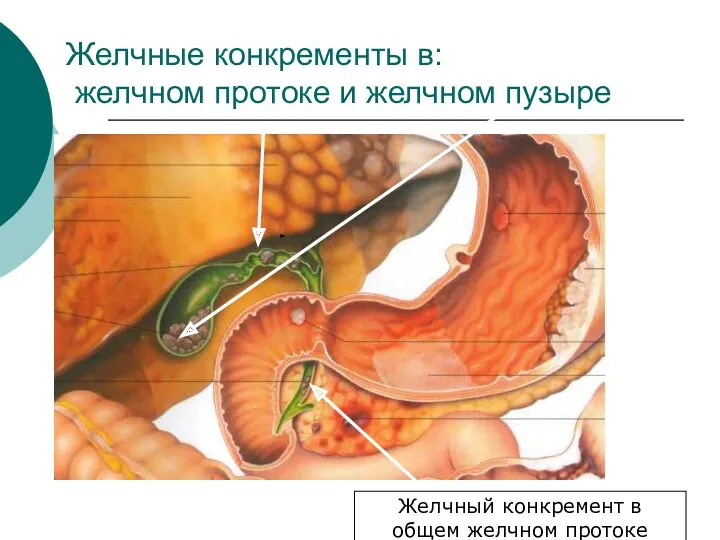
- 36. Желчные конкременты в: желчном протоке и желчном пузыре Желчный конкремент в общем желчном протоке
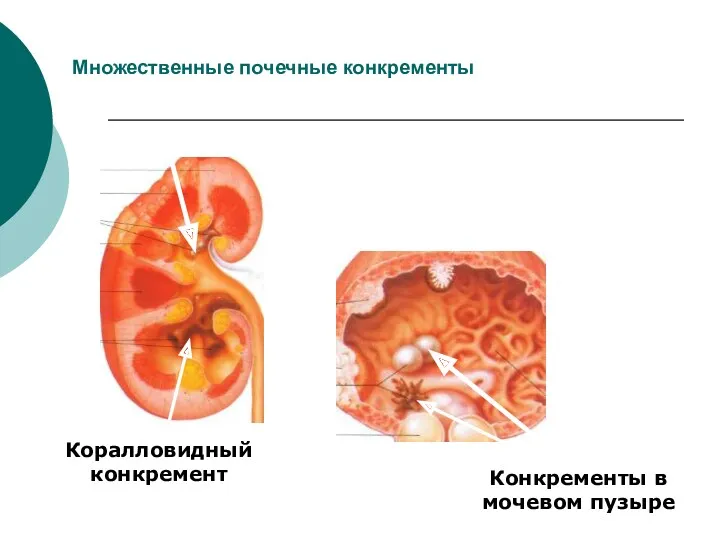
- 37. Множественные почечные конкременты Коралловидный конкремент Конкременты в мочевом пузыре
- 38. Комплексные соединения составляют наиболее обширный и разнообразный класс химических соединений. В живых организмах присутствуют комплексные соединения
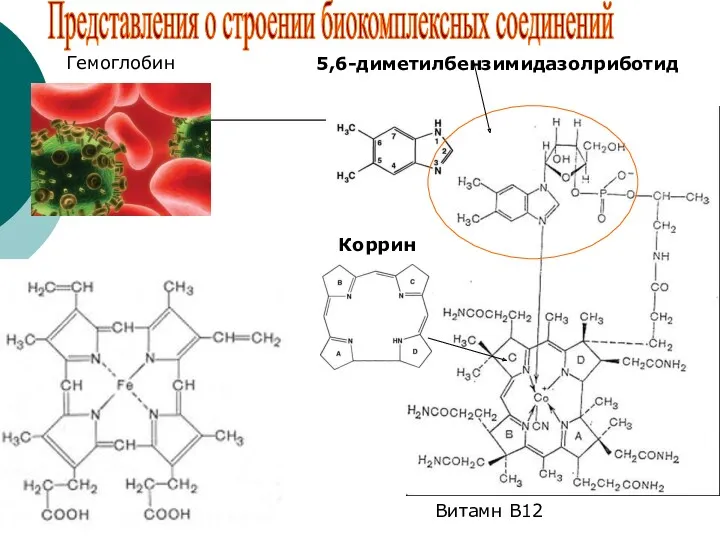
- 39. 5,6-диметилбензимидазолриботид Коррин Витамн В12 Гемоглобин Представления о строении биокомплексных соединений
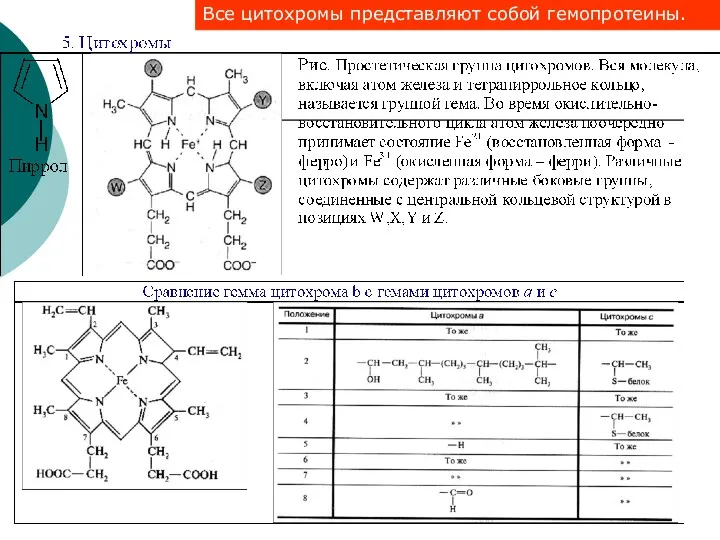
- 40. Все цитохромы представляют собой гемопротеины.
- 41. Координационная теория Вернера. Строение комплексных соединений: центральный атом, лиганды, координационное число Впервые свойства и строение комплексных
- 42. Комплексными соединениями называются соединения, существующие как в кристаллическом состоянии, так и в растворе, особенностью которых является
- 43. Координационную теорию Вернера рассмотрим на примере: K3 [Fe(CN)6] внешняя и внутренняя сфера Согласно данной теории, центральный
- 44. Число лигандов, окружающих центральный ион, называется координационным числом (КЧ). Центральный атом вместе с координированными лигандами образуют
- 45. Координационное число может иметь значения 2; 3; 4; 5; 6 и т. д. вплоть до 12
- 46. Во внутренней сфере связь комплексообразователя с лигандами имеет донорно – акцепторное происхождение и является ковалентной. Роль
- 47. Определение заряда (z) основных частиц комплексного соединения на примере: K[AI(OH)4]. Заряд внутренней сферы комплексного соединения равен
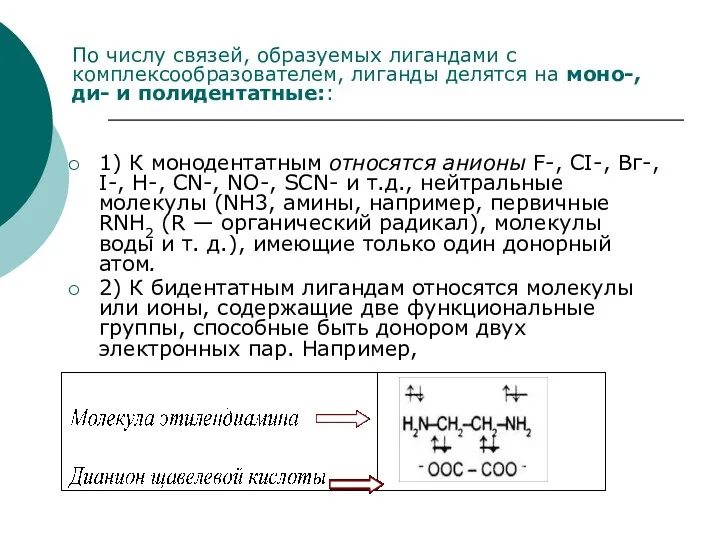
- 48. В качестве лигандов выступают молекулы или ионы, содержащие донорные атомы (наиболее распространенные N, Р, О, галогены),
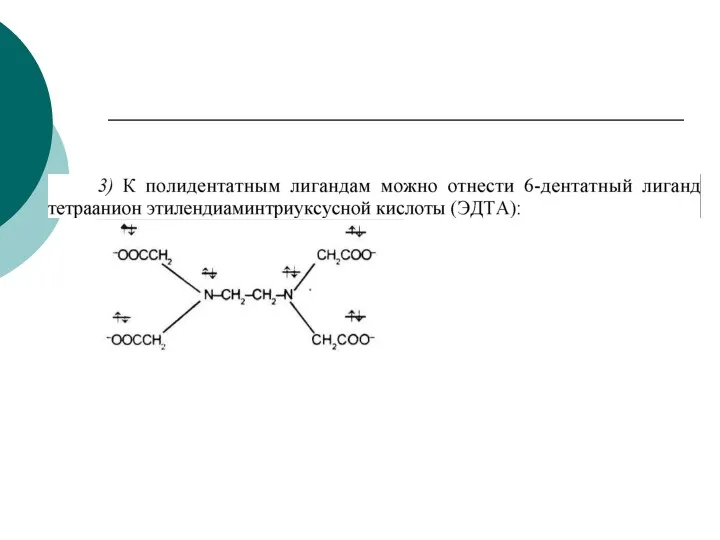
- 49. 1) К монодентатным относятся анионы F-, СI-, Вг-, I-, H-, CN-, NO-, SCN- и т.д., нейтральные
- 51. Номенклатура комплексных соединений сначала называют анион, а затем – катион в родительном падеже. Названия комплексных соединений
- 52. Число лигандов каждого рода указывают греческими числительными: ди-, три-, тетра- и т.д. Если комплексная частица является
- 54. Комплексное соединение [Pt(NH3)2CI2] внешней сферы не имеет и заряд комплекса равен 0.
- 59. Устойчивость комплексных соединений в растворах Внутренняя и внешняя сферы комплексного соединения сильно различаются по устойчивости; частицы,
- 65. Если ионизация комплексных ионов происходит по ступеням, то константы равновесия этих промежуточных реакций называются промежуточными или
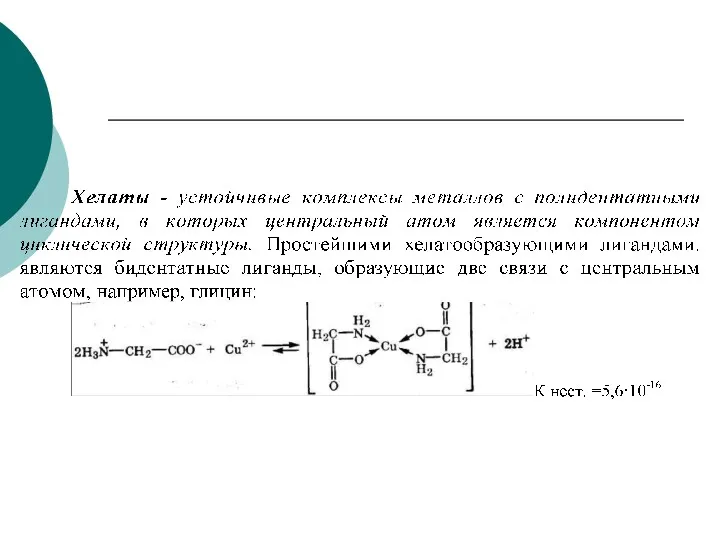
- 67. Особенно эффективное связывание ионов комплексообразователя происходит при реакции с полидентатными ( многозубыми) лигандами. Эти лиганды благодаря
- 69. Конкуренция за лиганд или за ион-комплексообразователь Процессы образования комплексного соединения иона металла с каждым из лигандов
- 72. Скачать презентацию



























![Координационную теорию Вернера рассмотрим на примере: K3 [Fe(CN)6] внешняя и](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/212518/slide-42.jpg)



![Определение заряда (z) основных частиц комплексного соединения на примере: K[AI(OH)4].](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/212518/slide-46.jpg)




![Комплексное соединение [Pt(NH3)2CI2] внешней сферы не имеет и заряд комплекса равен 0.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/212518/slide-53.jpg)














 Технология получения многослойного и малослойного графена
Технология получения многослойного и малослойного графена Жири як представники естерів. Класифікація жирів, їхні хімічні властивості
Жири як представники естерів. Класифікація жирів, їхні хімічні властивості 20230816_belki_2
20230816_belki_2 Халькогены
Халькогены Растворы. (Лекция 7)
Растворы. (Лекция 7) Химические элементы азот и фосфор
Химические элементы азот и фосфор Альдегиды и кетоны
Альдегиды и кетоны Буферное кислотно - основное взаимодействие
Буферное кислотно - основное взаимодействие Наглядное пособие Динамические модели. Кристаллы. Немолекулярные вещества. Простые вещества
Наглядное пособие Динамические модели. Кристаллы. Немолекулярные вещества. Простые вещества Химическая связь
Химическая связь Биологически активные вещества и их содержание в лекарственных растениях
Биологически активные вещества и их содержание в лекарственных растениях Основания. Степени окисления элементов в соединениях
Основания. Степени окисления элементов в соединениях Общая характеристика элементов V группы главной подгруппы
Общая характеристика элементов V группы главной подгруппы Диффузия вокруг нас
Диффузия вокруг нас Франций (Francium)
Франций (Francium) Термодинамика химических процессов
Термодинамика химических процессов Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Качественные реакции
Качественные реакции Минералы горных пород
Минералы горных пород Химический элемент радон
Химический элемент радон Осадочные и метаморфические горные породы
Осадочные и метаморфические горные породы Мило та миловаріння
Мило та миловаріння Кислотність та основність органічних сполук
Кислотність та основність органічних сполук Проведение лабораторных анализов образцов почвы
Проведение лабораторных анализов образцов почвы Подгруппа углерода
Подгруппа углерода Химический элемент алюминий
Химический элемент алюминий Пластические массы и изделия на их основе
Пластические массы и изделия на их основе Зависимость биохимических изменений в мясе от условий хранения
Зависимость биохимических изменений в мясе от условий хранения