Наглядное пособие Динамические модели. Кристаллы. Немолекулярные вещества. Простые вещества презентация
Содержание
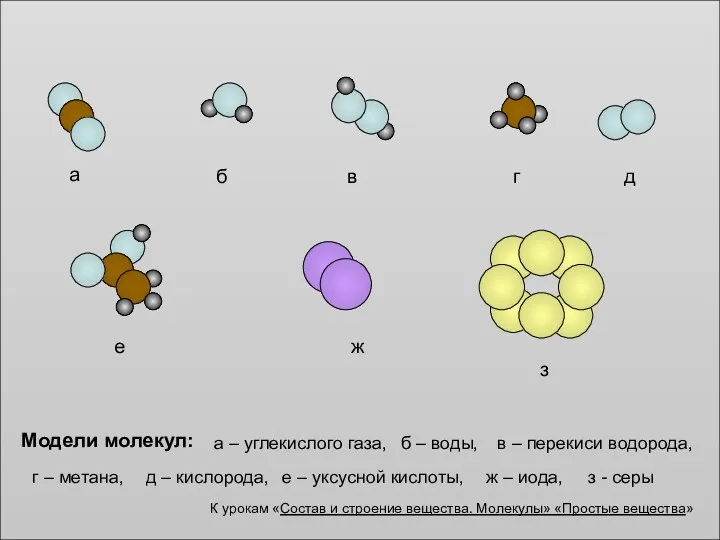
- 2. а Модели молекул: б г в е д ж з а – углекислого газа, б –
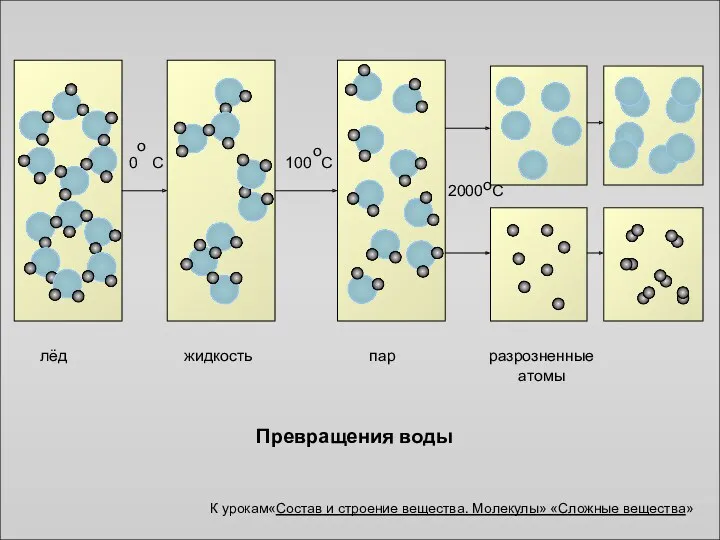
- 3. Превращения воды лёд пар жидкость разрозненные атомы К урокам«Состав и строение вещества. Молекулы» «Сложные вещества»
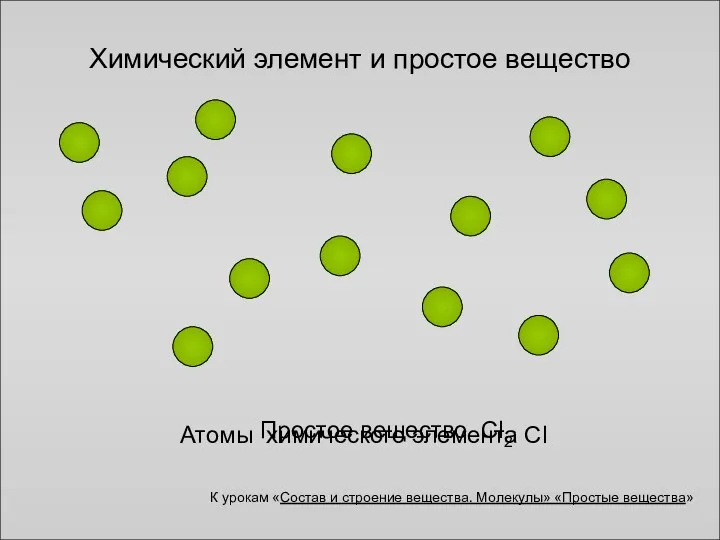
- 4. Химический элемент и простое вещество Атомы химического элемента Cl Простое вещество Cl2 К урокам «Состав и
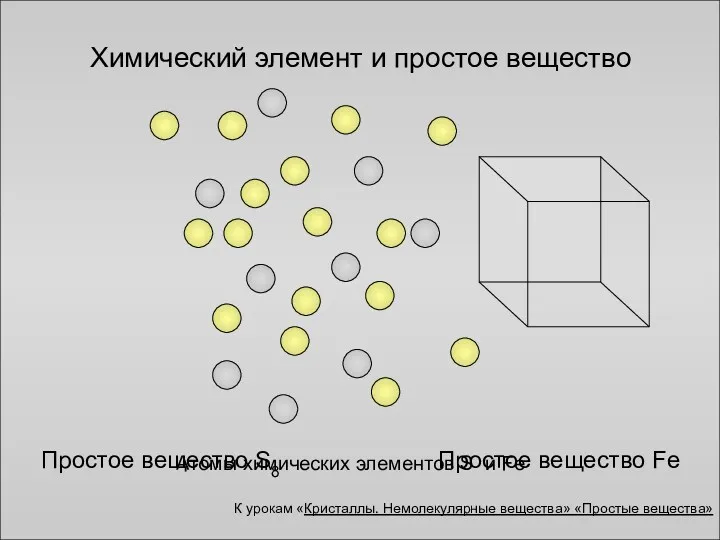
- 5. Атомы химических элементов S и Fe Простое вещество Fe Химический элемент и простое вещество Простое вещество
- 6. Химический элемент Al Простое вещество Al К урокам «Кристаллы. Немолекулярные вещества» «Простые вещества»
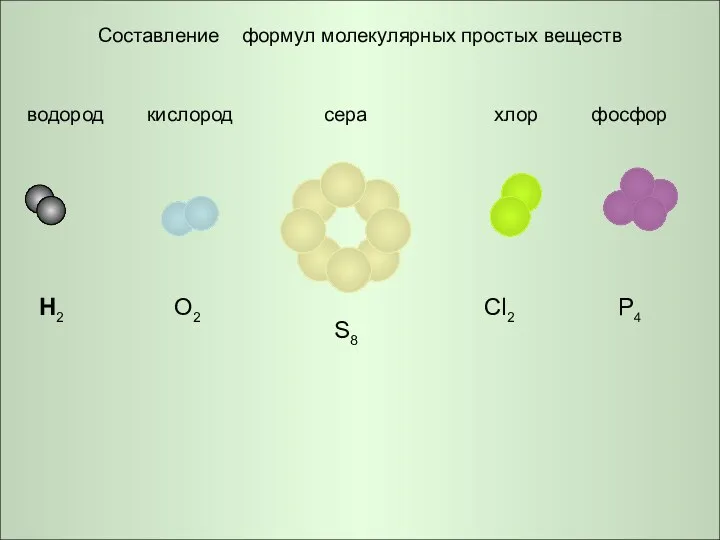
- 7. Составление формул молекулярных простых веществ водород кислород сера хлор фосфор H2 O2 S8 Cl2 P4
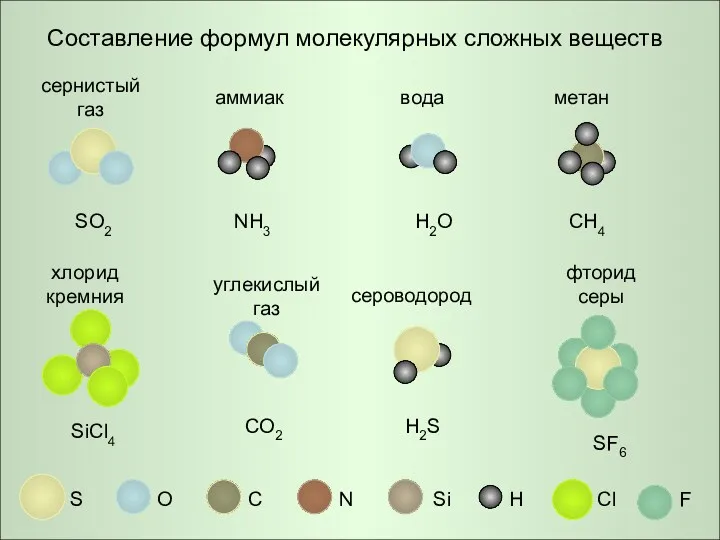
- 8. Составление формул молекулярных сложных веществ S O C N H Cl Si F сернистый газ аммиак
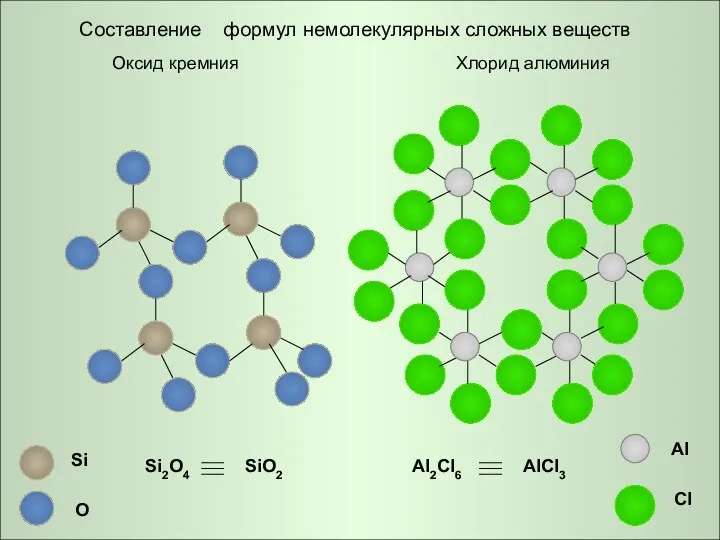
- 9. Al Cl Оксид кремния Si O Si2O4 SiO2 Al2Cl6 AlCl3 Хлорид алюминия Составление формул немолекулярных сложных
- 10. Модельная схема реакции 2Н2 + О2 = 2Н2О К уроку «Уравнения химических реакций»
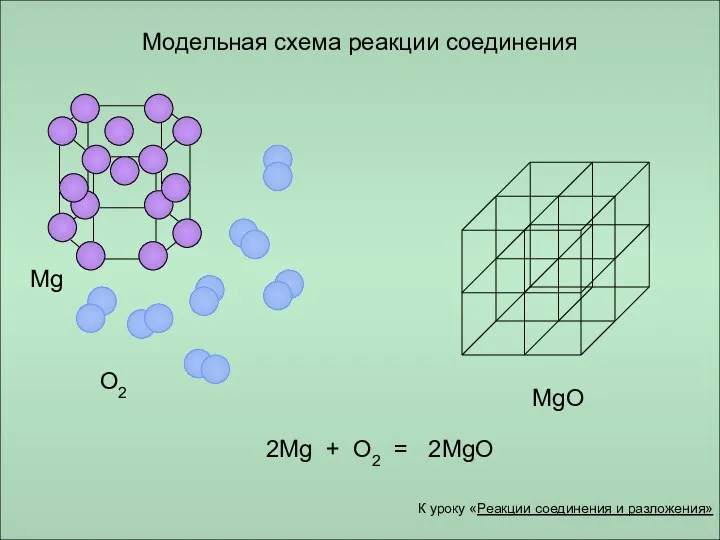
- 11. Модельная схема реакции соединения Mg O2 MgO 2Mg + O2 = 2MgO К уроку «Реакции соединения
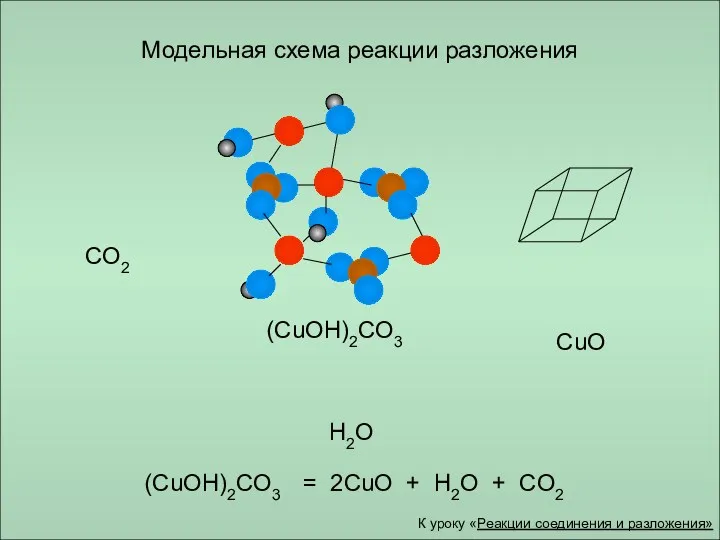
- 12. Модельная схема реакции разложения (CuOH)2CO3 CO2 CuO H2O (CuOH)2CO3 = 2CuO + H2O + CO2 К
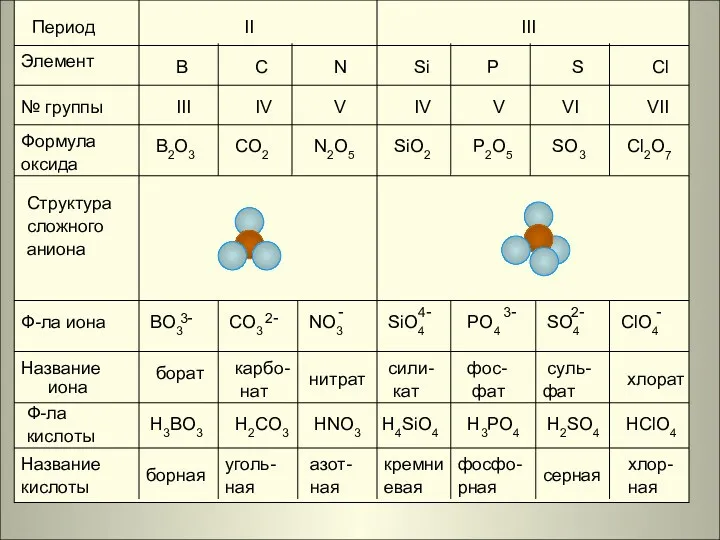
- 13. Период Элемент № группы Формула оксида Структура сложного аниона Ф-ла иона Название иона Ф-ла кислоты Название
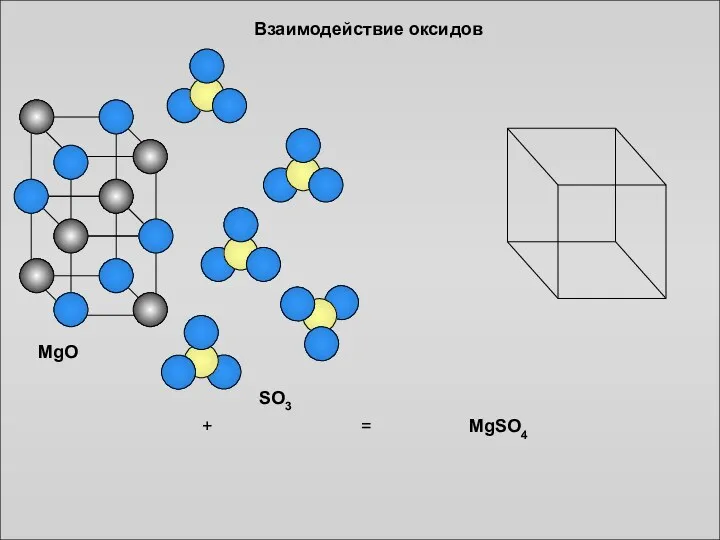
- 14. MgO SO3 + = MgSO4 Взаимодействие оксидов
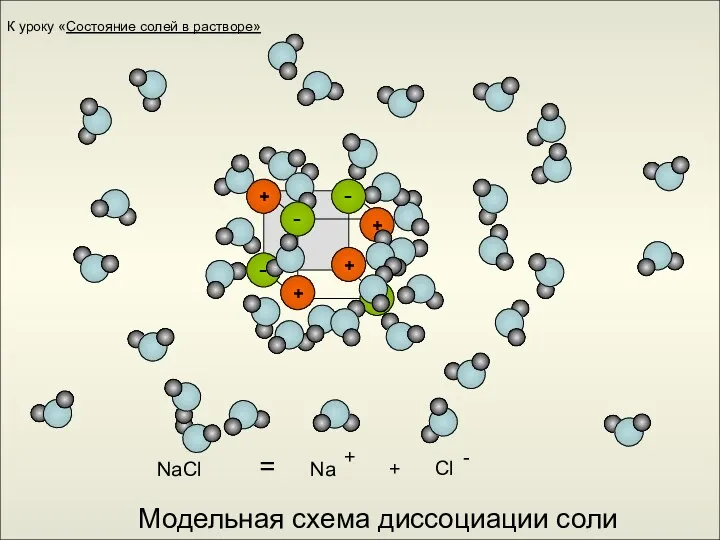
- 15. Модельная схема диссоциации соли NaCl = + Na + К уроку «Состояние солей в растворе»
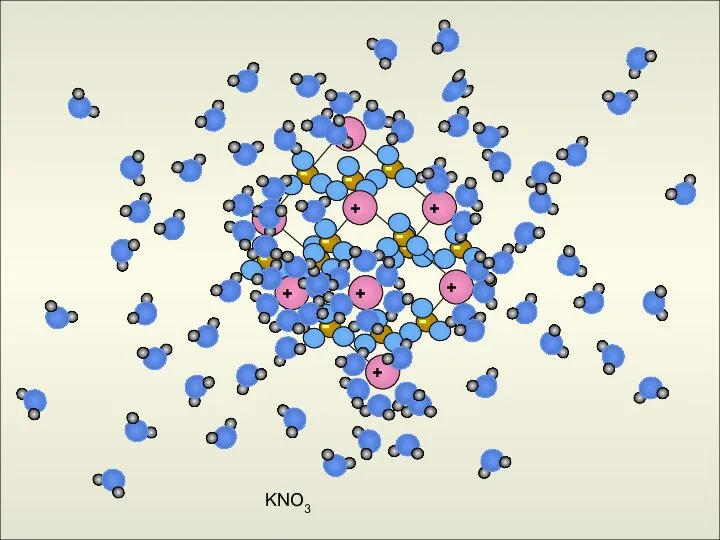
- 16. KNO3
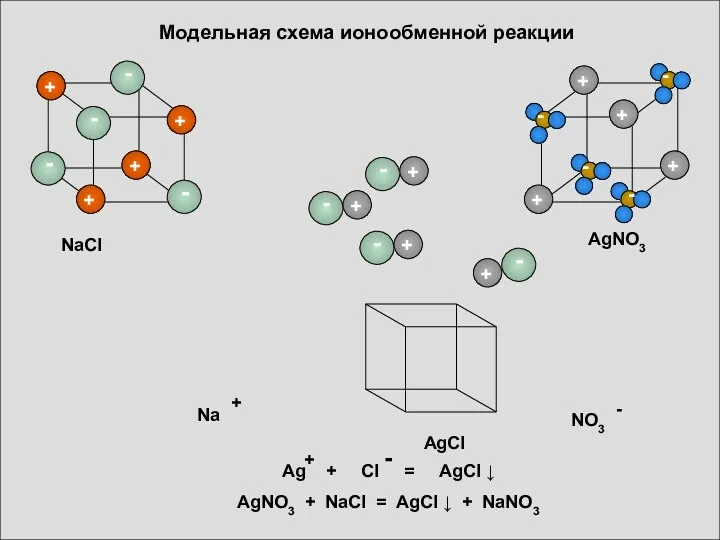
- 17. Модельная схема ионообменной реакции AgCl NaCl AgNO3
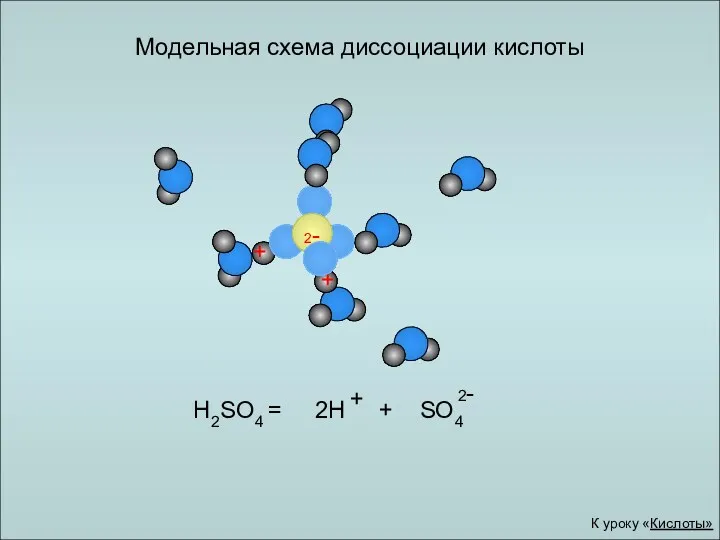
- 18. H2SO4 = 2H + SO4 Модельная схема диссоциации кислоты + 2- К уроку «Кислоты»
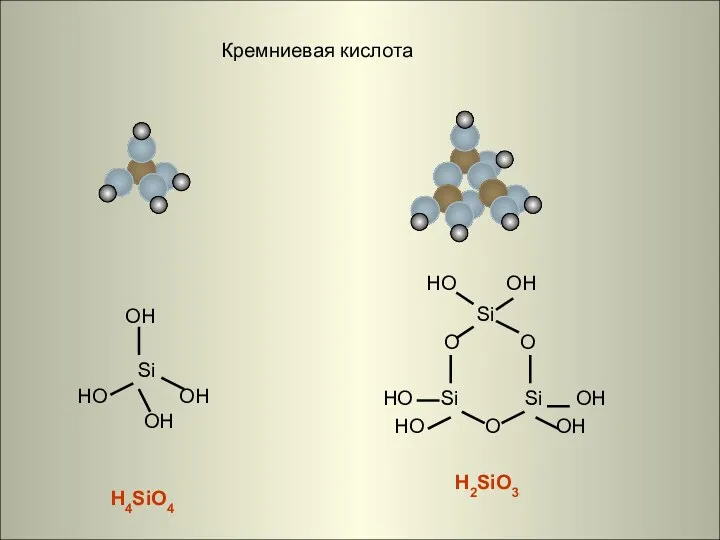
- 19. Кремниевая кислота OH Si HO OH OH H4SiO4 HO OH Si O O HO Si Si
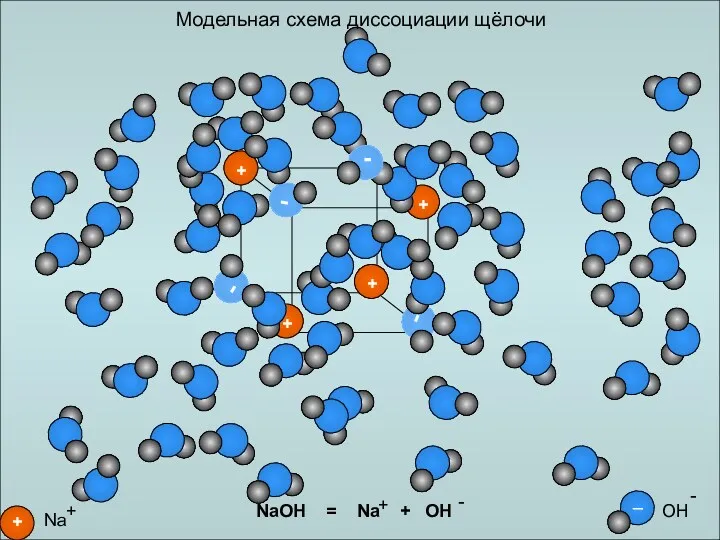
- 20. Модельная схема диссоциации щёлочи
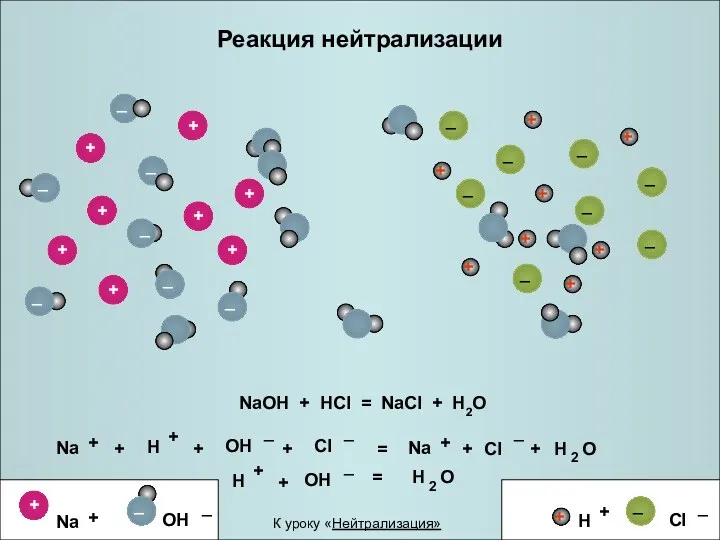
- 21. Реакция нейтрализации NaOH + HCl = NaCl + H2O + + = + + + +
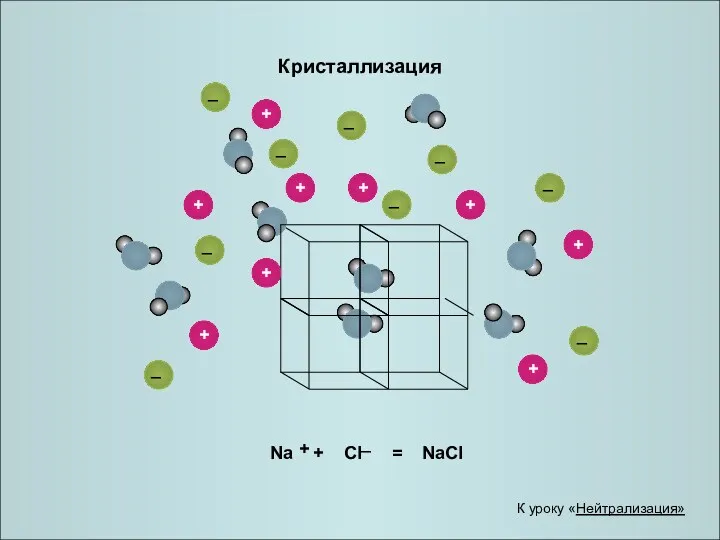
- 22. Кристаллизация К уроку «Нейтрализация»
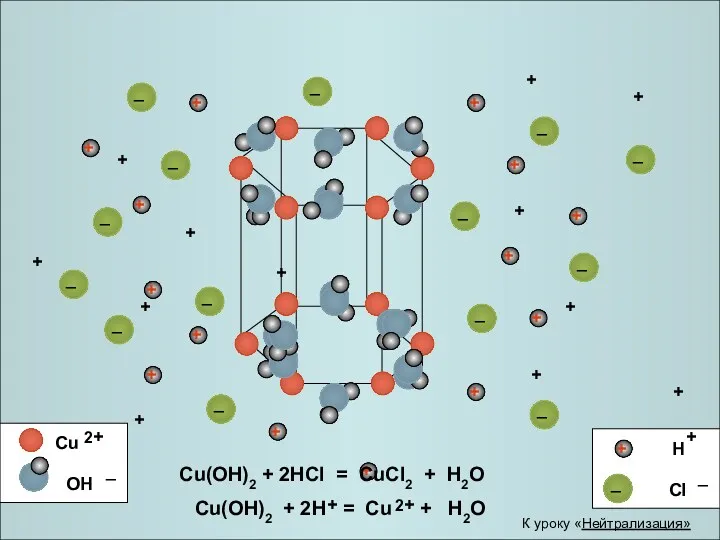
- 23. + + + + + + + + + + + + Cu(OH)2 + 2HCl =
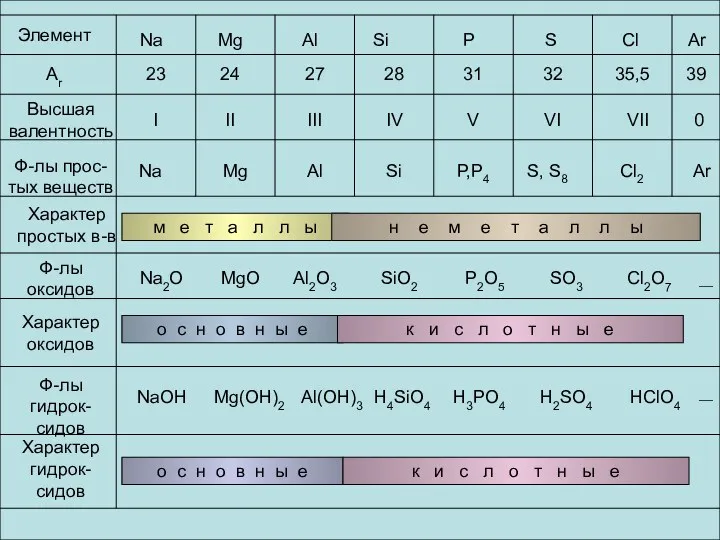
- 24. Элемент Аr Высшая валентность Ф-лы прос-тых веществ Характер простых в-в Ф-лы оксидов Характер оксидов Ф-лы гидрок-сидов
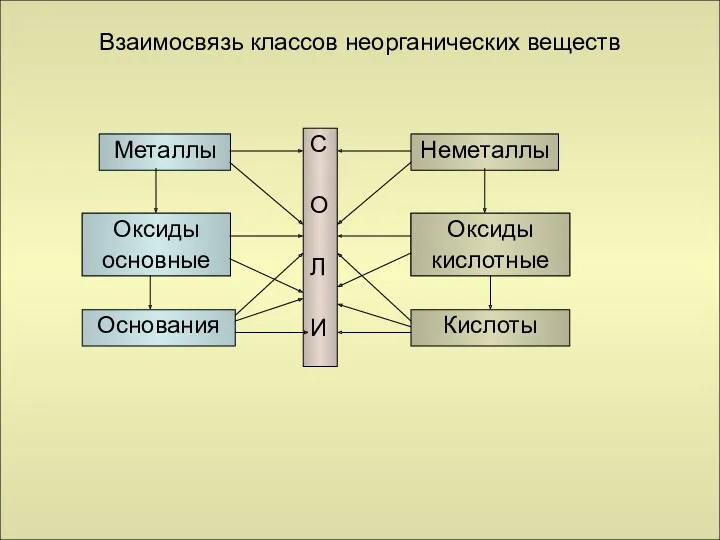
- 25. Взаимосвязь классов неорганических веществ Металлы Оксиды металлов Основания Неметаллы Оксиды неметаллов Кислоты С О Л И
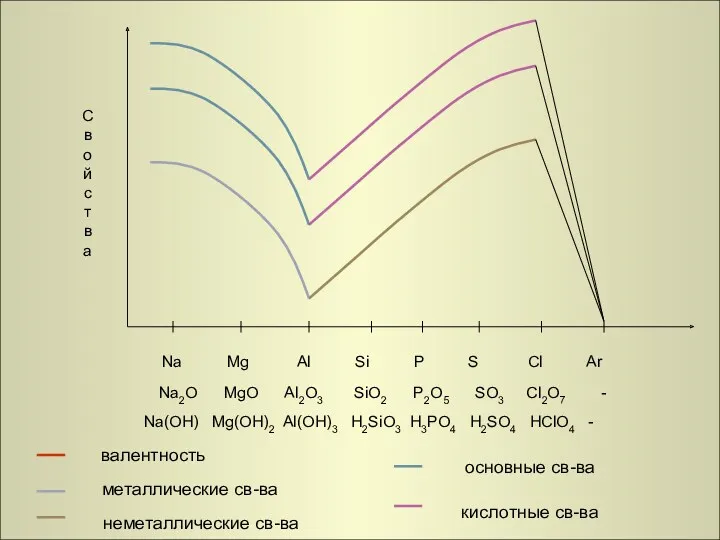
- 26. Na Mg Al Si P S Cl Ar Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7 -
- 28. Скачать презентацию


 Теплота згоряння. Температура горіння
Теплота згоряння. Температура горіння Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Лекция 6. Желтые пигменты
Лекция 6. Желтые пигменты Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна Електролітична дисоціація. Гідроліз солей
Електролітична дисоціація. Гідроліз солей Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием. Инструктаж по ТБ
Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием. Инструктаж по ТБ Зерттеу әдістері
Зерттеу әдістері Хлороводород..Соляная кислота
Хлороводород..Соляная кислота Фазовое равновесие
Фазовое равновесие Сероводород
Сероводород Франций (Francium)
Франций (Francium) Роль хімії у суспільстві
Роль хімії у суспільстві Кислородсодержащие органические вещества. Фенолы
Кислородсодержащие органические вещества. Фенолы Разнообразие неметаллов
Разнообразие неметаллов Минералогия с основами кристаллографии
Минералогия с основами кристаллографии Фізичні властивості та хімічний склад природних вод
Фізичні властивості та хімічний склад природних вод Припекание взаимно растворимых твердых тел
Припекание взаимно растворимых твердых тел Металл цирконий (ZR)
Металл цирконий (ZR) Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Химия в повседневной жизни человека
Химия в повседневной жизни человека Alyuminiy_ego_soedinenia
Alyuminiy_ego_soedinenia Углерод. Общая характеристика элементов подгруппы углерода
Углерод. Общая характеристика элементов подгруппы углерода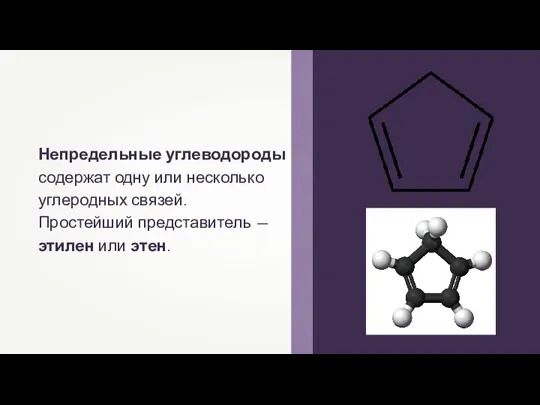 Физические и химические свойства алкенов
Физические и химические свойства алкенов Тип соли. Задачи к вопросу 34 по спецификации ЕГЭ-2019
Тип соли. Задачи к вопросу 34 по спецификации ЕГЭ-2019 Особенности органических веществ. Теория химического строения А.М.Бутлерова
Особенности органических веществ. Теория химического строения А.М.Бутлерова Химия нефти и газа
Химия нефти и газа Решение заданий по теме: Оксиды
Решение заданий по теме: Оксиды Кислоты, их классификация и свойства
Кислоты, их классификация и свойства