Содержание
- 2. Из глины я обыкновенной, И на редкость современный, Не боюсь электротока, Хозяйкам на кухне служу без
- 3. Алюминий
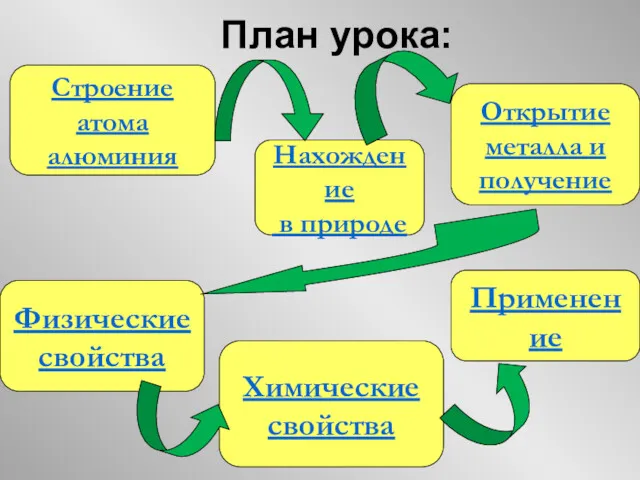
- 4. План урока: Строение атома алюминия Нахождение в природе Открытие металла и получение Физические свойства Химические свойства
- 5. Периодическая система химических элементов Д.И.Менделеева Группы элементов I II III IV VII VI V VIII 3
- 6. Периодическая система химических элементов Д.И.Менделеева Периоды 1 2 3 4 5 6 7 Ряды 1 2
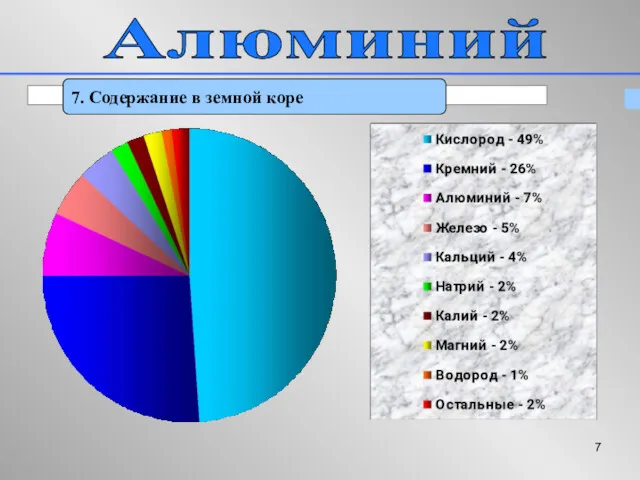
- 7. Алюминий 7. Содержание в земной коре
- 8. Алюминий Нахождение в природе
- 9. ПРИРОДНЫЕ СОЕДИНЕНИЯ АЛЮМИНИЯ АЛЮМОСИЛИКАТЫ КОРУНД Al2O3 – прозрачные кристаллы
- 10. Алюминий 1. Из истории открытия Впервые Al был получен датским физиком Эрстедом Х. в 1825 г.
- 11. Алюминий 1. Из истории открытия В период открытия алюминия - металл был дороже золота. Англичане хотели
- 12. В 1852г. килограмм алюминия стоил 1200 долларов – дороже золота! Когда его открыли в 1825 году,
- 13. К концу XX века алюминий стал намного дешевле , т.к. Чарльз Холл изобрел способ получения алюминия
- 14. Метод Холла позволил получать сравнительно недорогой алюминий в больших масштабах. Если с 1855 до 1890 г.
- 15. Метод Чарлза Холла позволял получать сравнительно недорогой алюминий в больших масштабах – началась эпоха алюминия…
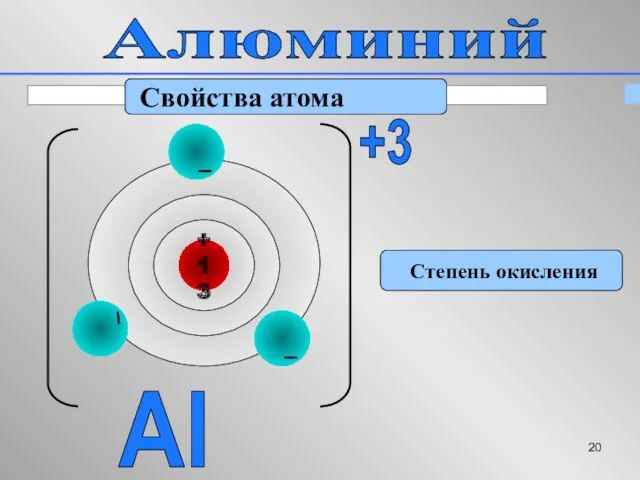
- 16. Алюминий Al 27 +13 0 2 8 3 p = 13 e = 13 n =
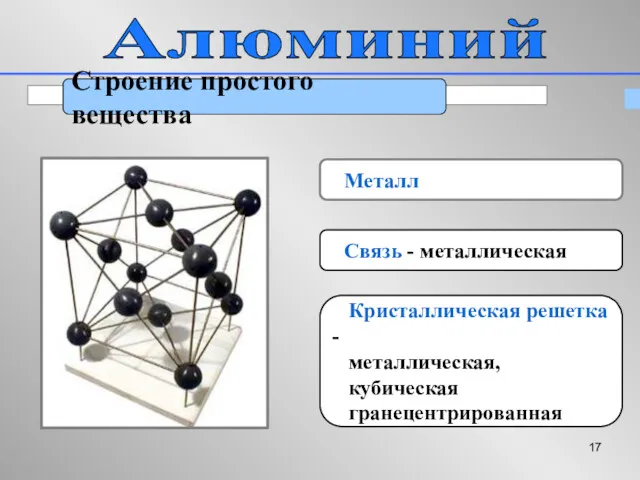
- 17. Алюминий Строение простого вещества Металл Связь - металлическая Кристаллическая решетка - металлическая, кубическая гранецентрированная
- 18. Алюминий Физические свойства
- 19. Алюминий покрыт тонкой, прочной оксидной пленкой tпл.Al2O3 = 2050 0C tпл.Al = 660 0C
- 20. Алюминий Свойства атома Степень окисления Al +3
- 21. Алюминий Свойства атома Восстановительные Электрохимический ряд напряжений металлов Li, K, Ca, Na, Mg, Al, Cr, Zn,
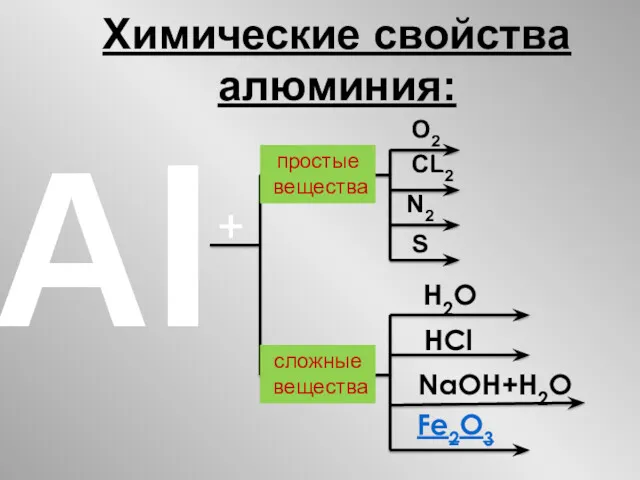
- 22. Химические свойства алюминия: Al + простые вещества сложные вещества О2 СL2 N2 S H2O NaOH+H2O HCl
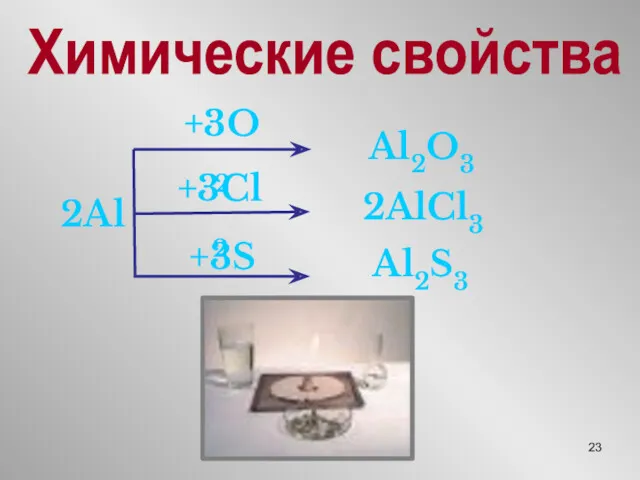
- 23. Химические свойства 2Al +3O2 Al2O3 +3Cl2 2AlCl3 +3S Al2S3
- 24. Химические свойства. С водой: 2Al + 3H2O = 2Al(OH)3 + 3H2 Почему алюминиевую посуду используют в
- 25. Алюминий – очень активный металл. Однако при комнатной температуре на воздухе алюминий не изменяется, поскольку его
- 26. Алюминий без защиты Лишенный оксидной пленки, алюминий активно взаимодействует с водой, а на воздухе быстро окисляется,
- 27. Химические свойства. С кислотами: соляной серной фосфорной 2Al + 6HCl = 2AlCl3 + 3H2 2Al +
- 28. НО образуется нерастворимая соль AlPO4. Доступ кислоты H3PO4 к алюминию невозможен. Реакция прекращается. Al + H3PO4
- 29. Алюминий – нетипичный металл 2 Аl + 6 HCl = 2 AlCl3 +3 Н2↑ алюминий хлорид
- 30. Химическая природа Al2O3 Al2O3 – амфотерен Al2O3 + 6 НCl = 2AlCl3 + 3 Н2О Al2O3+2NaOH+6H2O
- 31. Почему алюминиевую кастрюлю не рекомендуется мыть с содой ? Раствор соды обладает щелочной реакцией, поэтому алюминий
- 32. Химические свойства. С растворами солей: хлоридом железа (III) хлоридом натрия Al + FeCl3 = AlCl3 +
- 33. Al + NaCl ? AlCl3 +Na Но алюминий в электрохимическом ряду напряжений металлов: K Ca Na
- 34. Алюминий может покраснеть …!!! 2Аl + 3СиSO4 = Al2(SO4 )3 + 3 Cu Al – является
- 35. Это реакция алюминотермии Аl и в этой реакции «работает» как восстановитель 2 Al + Fe2O3 =
- 36. Алюминий Получение
- 37. Применение алюминия Al
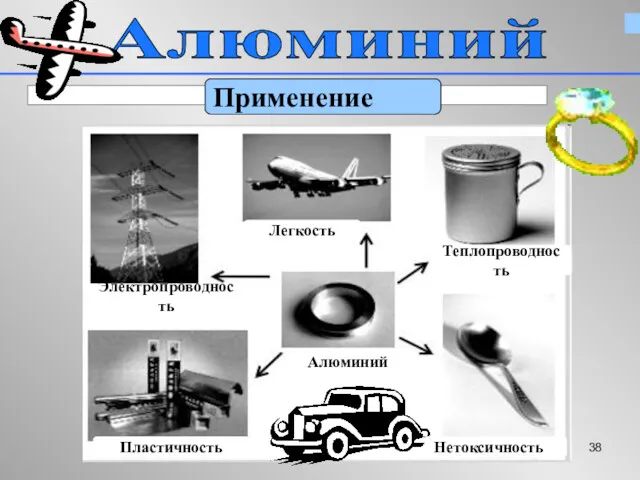
- 38. Алюминий Применение
- 39. Алюминий - крылатый металл
- 40. Алюминий – «крылатый металл» Входит в состав известных сплавов – дюралюминий, магналий, силумин, используемых в самолетостроении
- 41. Алюминий и его сплавы широко применяют как конструкционный материал
- 43. Конструкционные сплавы в архитектуре городов
- 45. В том числе при изготовлении транспортных средств
- 47. Алюминий в электротехнике Используемые свойства Высокая электропроводность Легкость При одинаковом электросопротивлении алюминиевый провод весит вдвое меньше
- 49. Из алюминия делают линии электропередач, ёмкости, цистерны, «серебряную» краску.
- 50. Алюминий в быту Используемые свойства: легкость,прочность,коррозионная прочность, нетоксичность
- 51. Термит – смесь Fe3O4 с порошком Al. При поджигании смеси происходит энергичная реакция с выделением большого
- 52. Металл будущего Вывод: Обладая такими свойствами как лёгкость, прочность, коррозионноустойчивость, устойчивость к действию сильных химических реагентов
- 54. Скачать презентацию











































 Подгруппа серы и ее соединения
Подгруппа серы и ее соединения Галогены. Фтор, хлор, бром, йод, астат
Галогены. Фтор, хлор, бром, йод, астат Results of lab test NG RO: Bypass, UV-lamp, membrane Toray 3012 800-1000 GPD
Results of lab test NG RO: Bypass, UV-lamp, membrane Toray 3012 800-1000 GPD Строение и электрический заряд коллоидных частиц. Электрокинетические явления
Строение и электрический заряд коллоидных частиц. Электрокинетические явления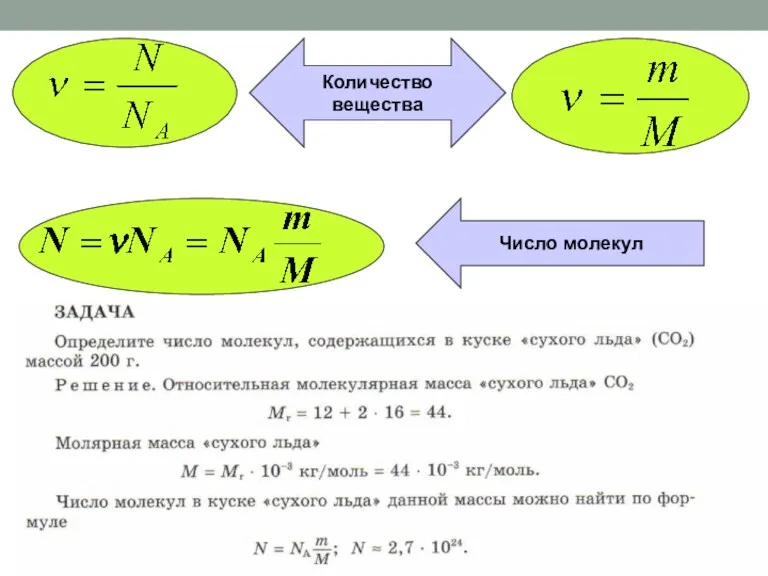 Количество вещества
Количество вещества Физические методы стабилизации масел
Физические методы стабилизации масел Химический элемент кремний
Химический элемент кремний Поверхностные явления. Типы поверхностных явлений
Поверхностные явления. Типы поверхностных явлений Нанотехнологии и Наноматериалы
Нанотехнологии и Наноматериалы Правила по технике безопасности в химической лаборатории
Правила по технике безопасности в химической лаборатории Железо, его физические и химические свойства. Урок химии в 9 классе
Железо, его физические и химические свойства. Урок химии в 9 классе Влияние газированных напитков на организм человека
Влияние газированных напитков на организм человека ПРИРОДНЫЕ ИСТОЧНИКИ УГЛЕВОДОРОДОВ
ПРИРОДНЫЕ ИСТОЧНИКИ УГЛЕВОДОРОДОВ Химический факультет
Химический факультет Химиялық элемент оттегі
Химиялық элемент оттегі Сплавы железа с углеродом: стали и чугуны
Сплавы железа с углеродом: стали и чугуны Ауыр металлдар
Ауыр металлдар ООО Ангарский Азотно-туковый завод. Основы производства аммиака
ООО Ангарский Азотно-туковый завод. Основы производства аммиака Основания. Номенклатура оснований
Основания. Номенклатура оснований Железо. Соединения железа
Железо. Соединения железа Біріншілік алкилсульфаттар және алкилэтоксисульфаттар немесе біріншілік спирттегі сульфоэфирдің тұздары. 4 Лекция
Біріншілік алкилсульфаттар және алкилэтоксисульфаттар немесе біріншілік спирттегі сульфоэфирдің тұздары. 4 Лекция Воздух и его состав
Воздух и его состав Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции
Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции Химия в повседневной жизни человека
Химия в повседневной жизни человека Главная подгруппа IV группы
Главная подгруппа IV группы Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Кинетика химических реакций. Химическое равновесие
Кинетика химических реакций. Химическое равновесие Свойства и биологическая роль карбонильных соединений
Свойства и биологическая роль карбонильных соединений