Содержание
- 2. Индикаторы Индикаторы – это вещества, которые меняют цвет при взаимодействии с разными группами сложных веществ
- 3. Окраска индикаторов Вещества, в формулах которых на первом месте был водород при взаимодействии с индикаторами показали
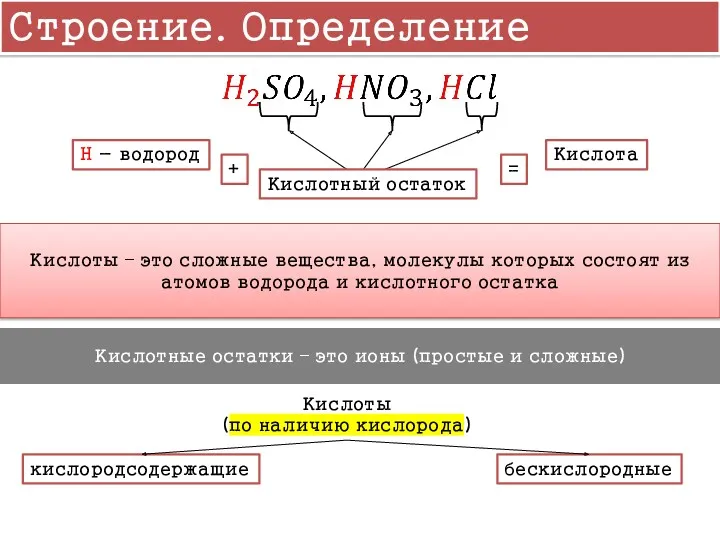
- 4. Строение. Определение Кислотный остаток H - водород Кислота + = Кислоты – это сложные вещества, молекулы
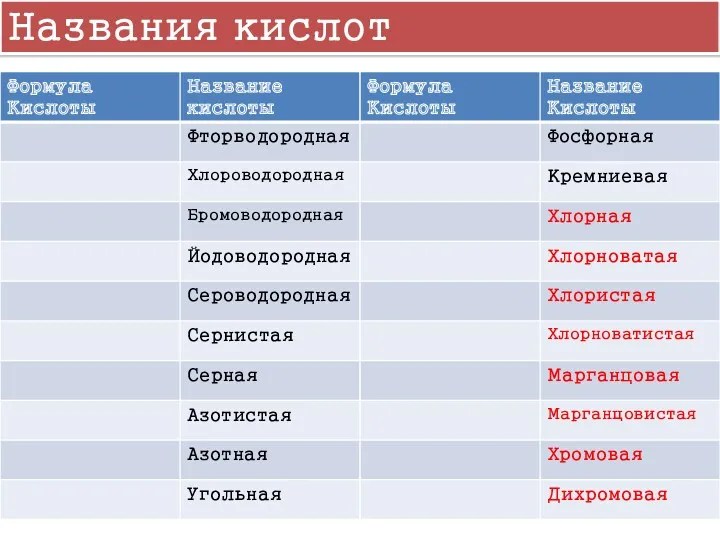
- 5. Названия кислот
- 6. Анализ формулы кислоты H Cl – соляная кислота (хлороводородная) хлорид водорода (нет) +1 -1 H S
- 7. Простое вещество, суммарная СО равна нулю, существует отдельно! Сложный ион, имеет отрицательный суммарный заряд, отдельно не
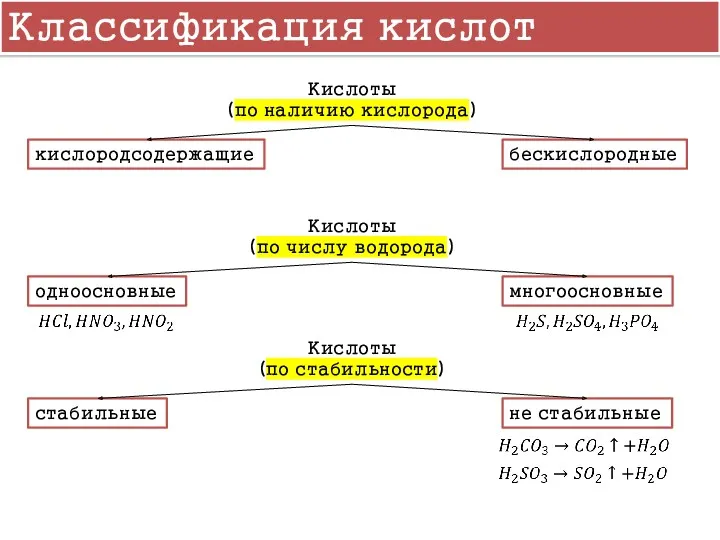
- 8. Классификация кислот Кислоты (по наличию кислорода) кислородсодержащие бескислородные Кислоты (по числу водорода) одноосновные многоосновные Кислоты (по
- 10. Скачать презентацию




 Хром
Хром Серная кислота H2SO4
Серная кислота H2SO4 Органические соединения амины
Органические соединения амины Алкадиены
Алкадиены Важнейшие оксиды в природе и жизни человека
Важнейшие оксиды в природе и жизни человека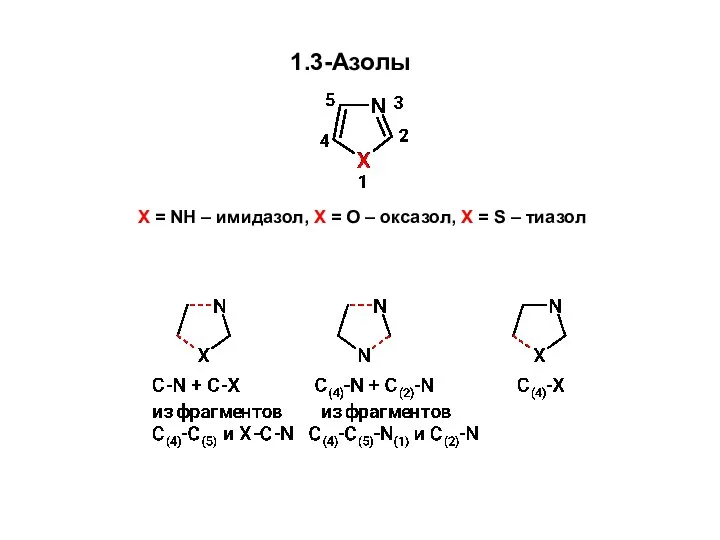 Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N
Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N Алмастырылмайтын аминқышқылды алу биотехнологиясы
Алмастырылмайтын аминқышқылды алу биотехнологиясы Мини-тақталарда немесе дәптерде қатты, сұйық және газтектес заттардың құрылысын сал
Мини-тақталарда немесе дәптерде қатты, сұйық және газтектес заттардың құрылысын сал Типы химических реакций
Типы химических реакций Общие представления о фазовых состояниях и фазовых переходах полимеров
Общие представления о фазовых состояниях и фазовых переходах полимеров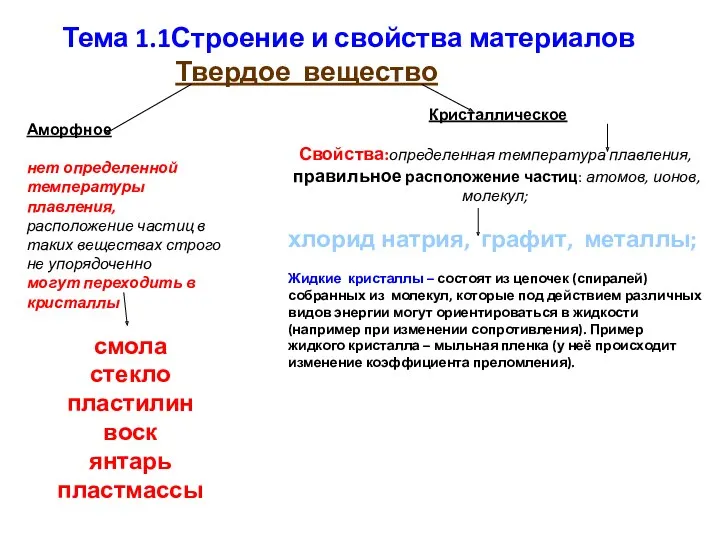 Строение и свойства материалов. Тема 1.1
Строение и свойства материалов. Тема 1.1 Классификация химических реакций
Классификация химических реакций Основы кристаллографии
Основы кристаллографии Оксиды. Химические свойства оксидов
Оксиды. Химические свойства оксидов Химические источники тока. Электролиз
Химические источники тока. Электролиз Влияние спирта на здоровье человека
Влияние спирта на здоровье человека Изотопы. История открытия. Изотопы водорода
Изотопы. История открытия. Изотопы водорода Простые эфиры
Простые эфиры Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения Новое направление в бизнесе компании – катализаторы синтеза метанола
Новое направление в бизнесе компании – катализаторы синтеза метанола Эквивалент. Лекция 1
Эквивалент. Лекция 1 Массовая доля вещества в растворе
Массовая доля вещества в растворе Азот. Соединения азота
Азот. Соединения азота Выращивание кристалла медного купороса
Выращивание кристалла медного купороса Поверхностные явления
Поверхностные явления Цинк. Месторождения. Применение
Цинк. Месторождения. Применение Растворы. Основные понятия. Концентрация. Законы Рауля
Растворы. Основные понятия. Концентрация. Законы Рауля Минералы и их основные морфологические характеристики
Минералы и их основные морфологические характеристики