Содержание
- 2. Поверхностные явления – те эффекты и особенности поведения веществ, которые наблюдаются на поверхности раздела фаз. К
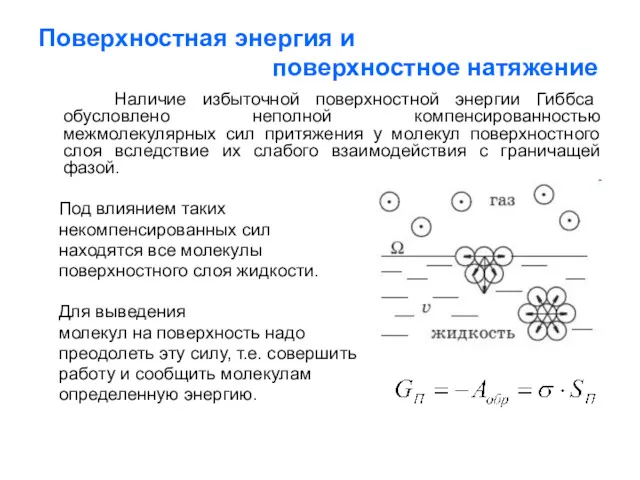
- 3. Поверхностная энергия и поверхностное натяжение Наличие избыточной поверхностной энергии Гиббса обусловлено неполной компенсированностью межмолекулярных сил притяжения
- 4. Физический смысл поверхностного натяжения Энергетическая трактовка: поверхностное натяжение равно работе, затраченной на образование единицы поверхности: ,
- 5. Благодаря поверхностному натяжению капля жидкости в свободном падении принимает сферическую форму.
- 6. Факторы, влияющие на поверхностное натяжение 1) Температура С увеличением температуры σ уменьшается. Температура, при которой поверхностное
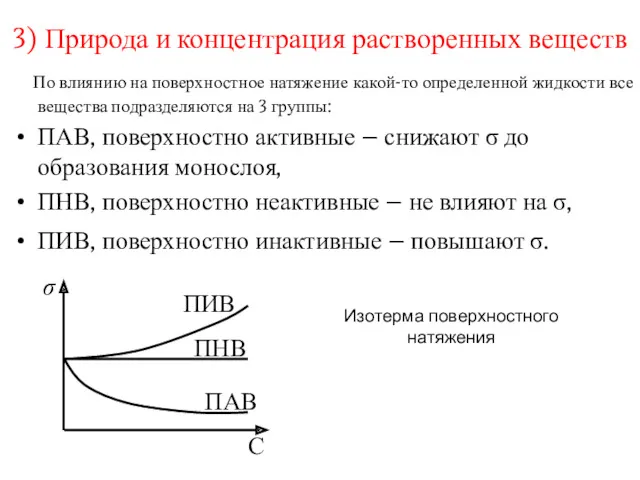
- 7. 3) Природа и концентрация растворенных веществ По влиянию на поверхностное натяжение какой-то определенной жидкости все вещества
- 8. ПИВ являются неорганические вещества (электролиты). Ионы хорошо гидратируются (взаимодействуют с молекулами воды), поэтому они интенсивно втягиваются
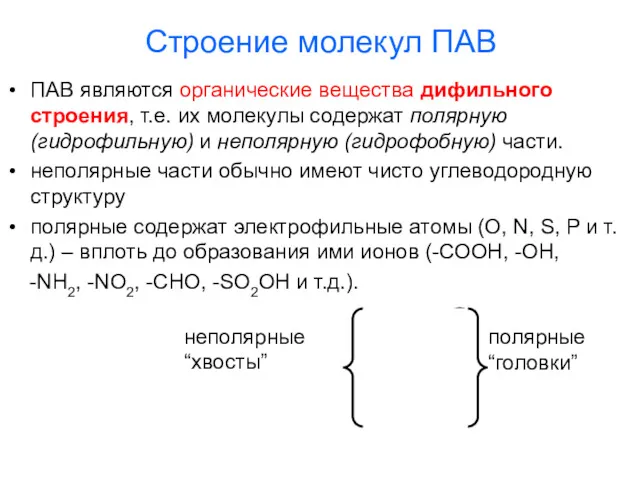
- 9. Строение молекул ПАВ ПАВ являются органические вещества дифильного строения, т.е. их молекулы содержат полярную (гидрофильную) и
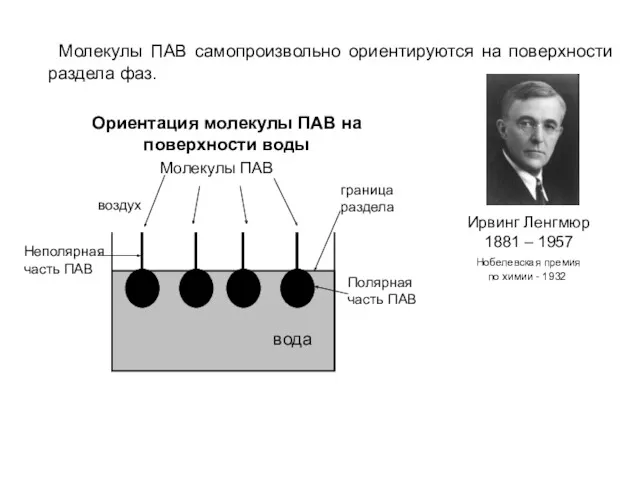
- 10. Молекулы ПАВ самопроизвольно ориентируются на поверхности раздела фаз. Ирвинг Ленгмюр 1881 – 1957 Нобелевская премия по
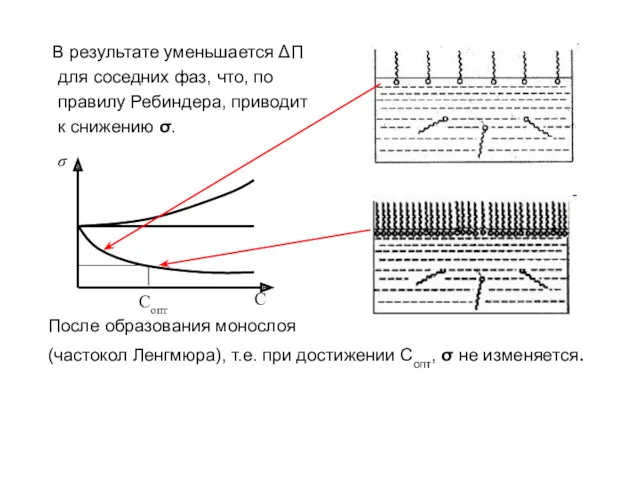
- 11. В результате уменьшается ΔП для соседних фаз, что, по правилу Ребиндера, приводит к снижению σ. После
- 13. Поверхностная активность Количественной мерой способности ПАВ понижать поверхностное натяжение на границе раздела фаз служит поверхностная активность
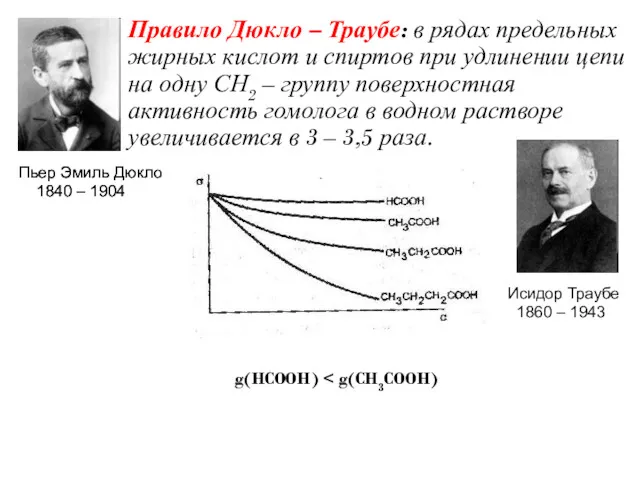
- 14. Правило Дюкло – Траубе: в рядах предельных жирных кислот и спиртов при удлинении цепи на одну
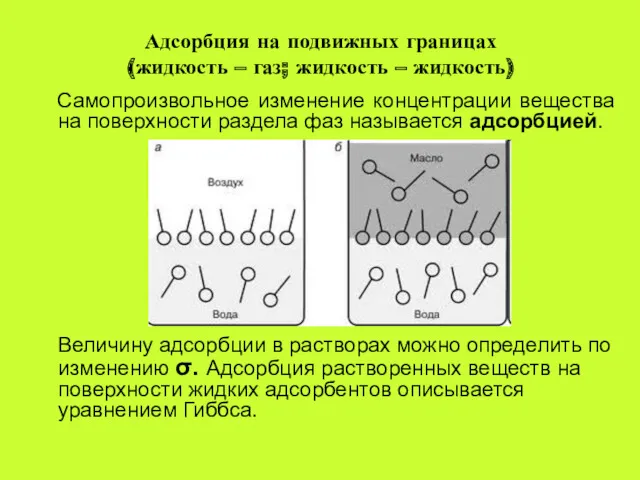
- 15. Адсорбция на подвижных границах (жидкость – газ; жидкость – жидкость) Самопроизвольное изменение концентрации вещества на поверхности
- 16. Изотерма адсорбции Гиббса Уравнение, описывающее зависимость между адсорбцией и концентрацией вещества называется изотермой адсорбции. Уравнение адсорбции
- 17. Адсорбция на неподвижных границах (твердое тело – газ; твердое тело – раствор) Причиной адсорбции на твердых
- 18. Физическая адсорбция (ФАд) возникает за счет ван-дер-ваальсовых взаимодействий и происходит на активных центрах (во впадинах поверхности).
- 19. Твердое тело, на котором происходит адсорбция, называют адсорбентом; Адсорбированное вещество, находящееся на поверхности или в объеме
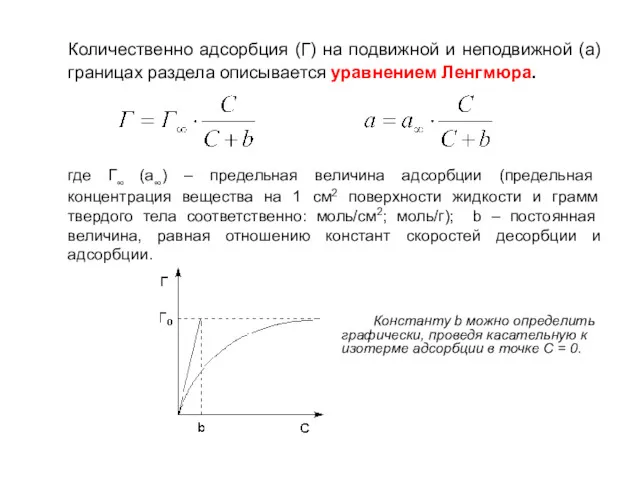
- 20. Количественно адсорбция (Г) на подвижной и неподвижной (а) границах раздела описывается уравнением Ленгмюра. где Г∞ (а∞)
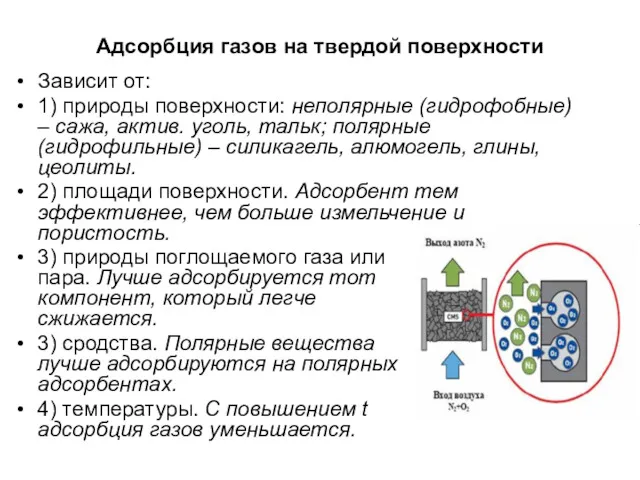
- 21. Адсорбция газов на твердой поверхности Зависит от: 1) природы поверхности: неполярные (гидрофобные) – сажа, актив. уголь,
- 22. Молекулярная адсорбция на границе твердое тело – раствор Отличие от адсорбции газов заключается в конкуренции между
- 23. 5) природы поглощаемого вещества (адсорбата): а) Правило Шилова: чем больше растворимость вещества в растворителе, тем хуже
- 24. Адсорбция ионов из растворов в зависимости от природы адсорбента подразделяется на ионную адсорбцию и ионнообменную адсорбцию
- 25. Ионная адсорбция По сравнению с молекулярной адсорбцией более сложный процесс, т.к. в растворе присутствует уже 3
- 26. Зависит от: 1) природы адсорбента. Чем более полярный адсорбент, тем лучше адсорбция ионов. 2) природы иона:
- 27. Избирательная адсорбция ионов подчиняется правилу Панета – Фаянса Например: на AgI могут адсорбироваться Ag+ и I-,
- 28. Ионообменная адсорбция Ионообменная адсорбция – это процесс, при котором твердый адсорбент обменивает свои ионы на ионы
- 29. Иониты подразделяют на катиониты, анионита и амфотерные иониты Катиониты (катионообменные сорбенты) – представляют собой нерастворимые многоосновные
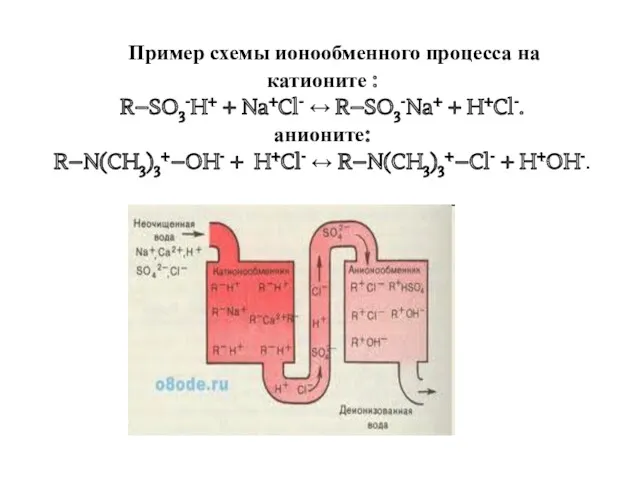
- 30. Пример схемы ионообменного процесса на катионите : R–SO3-H+ + Na+Cl- ↔ R–SO3-Na+ + H+Cl-. анионите: R–N(CH3)3+–OH-
- 32. Скачать презентацию


















 Сабын
Сабын Азотная кислота. К уроку химии для 9 класса
Азотная кислота. К уроку химии для 9 класса Волшебница - вода
Волшебница - вода Неоднородные системы, их классификация, методы разделения. Лекция 4
Неоднородные системы, их классификация, методы разделения. Лекция 4 Предельные и непредельные углеводороды
Предельные и непредельные углеводороды Действующие вещества. Лексикон
Действующие вещества. Лексикон Курс Материаловедение. Введение
Курс Материаловедение. Введение Классификация химических элементов
Классификация химических элементов Природные источники углеводородов
Природные источники углеводородов Теплогенерация. Топливо и его горение
Теплогенерация. Топливо и его горение Аммиак
Аммиак Хімія та обмін вуглеводів
Хімія та обмін вуглеводів Галогены. Астат
Галогены. Астат Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар
Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар Вред Coca-Cola на организм человека
Вред Coca-Cola на организм человека Сульфиды — природные сернистые соединения металлов и некоторых неметаллов
Сульфиды — природные сернистые соединения металлов и некоторых неметаллов Номенклатура углеводородов: алканов алкенов алкинов. Создание учебного пособия
Номенклатура углеводородов: алканов алкенов алкинов. Создание учебного пособия Формальная кинетика. Предмет химической кинетики
Формальная кинетика. Предмет химической кинетики Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов
Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Соединения кремния
Соединения кремния Відкриття та походження хімічних елементів
Відкриття та походження хімічних елементів Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Алкалоиды. Выделение и очистка алкалоидов
Алкалоиды. Выделение и очистка алкалоидов Координационные комплексные соединения
Координационные комплексные соединения Проект узла регенерации растворителя уксусной кислоты производства терефталевой кислоты
Проект узла регенерации растворителя уксусной кислоты производства терефталевой кислоты Ионные уравнения
Ионные уравнения Жиры
Жиры