Содержание
- 2. Историческая справка Монах-алхимик Бонавентура в 1270 году в поисках универсального растворителя «алкагеста» решил нагреть смесь железного
- 3. Благодаря этому веществу русский учёный В.Ф. Петрушевский в 1866 году впервые получил динамит. Это вещество является
- 4. Что же это за вещество ?
- 5. АЗОТНАЯ КИСЛОТА
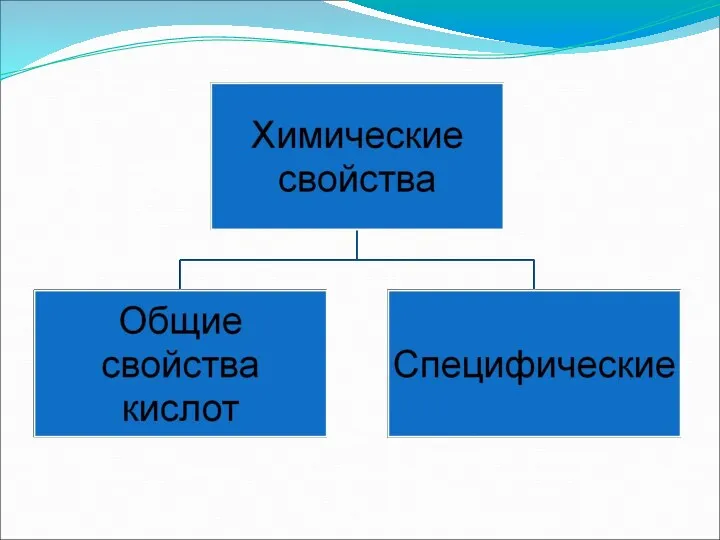
- 6. Дайте характеристику азотной кислоте. Определите степень окисления азота в азотной кислоте. Какая связь между соединениями в
- 7. Физические свойства HNO3 – азотная кислота 1.Азотная кислота бесцветная жидкость, которая «дымится» на воздухе. 2.Концентрированная азотная
- 9. 1) Изменяет цвет индикаторов (диссоциация) HNO3 -> H+ +NO3- 2) Взаимодействие с основными и амфотерными оксидами
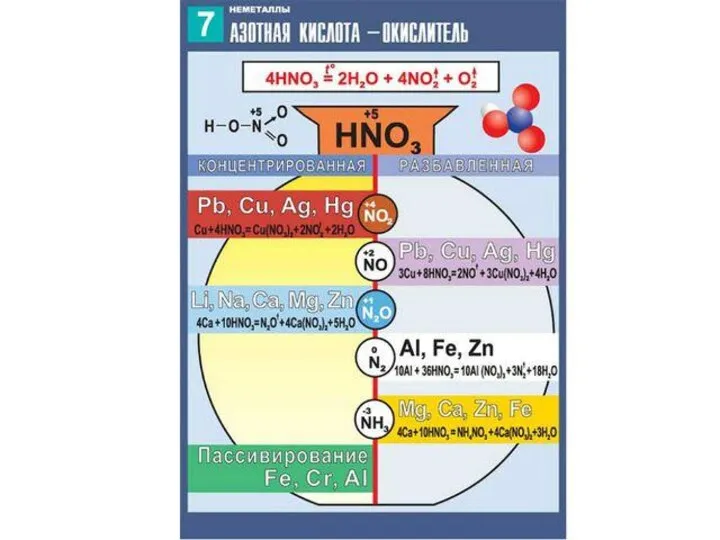
- 10. Специфические свойства – взаимодействие с металлами ЗАПОМНИ! При взаимодействии азотной кислоты любой концентрации с металлами водород
- 12. Специфические свойства . Взаимодействие разбавленной HNO3 с металлами. 1)Zn+HNO3(разб)=Zn(NO3)2+N2+H2O Zn0-2е=Zn+2 восстановитель, процесс окисление 5N2 +10е=2N0 окислитель,
- 13. 3)Ag+HNO3=NO+ AgNO3+H2O Ag0-е=Ag восстановитель, процесс окисление N+5 +3е=N+2 окислитель, процесс восстановление 3Ag+4HNO3=NO+ 3AgNO3+2H2O
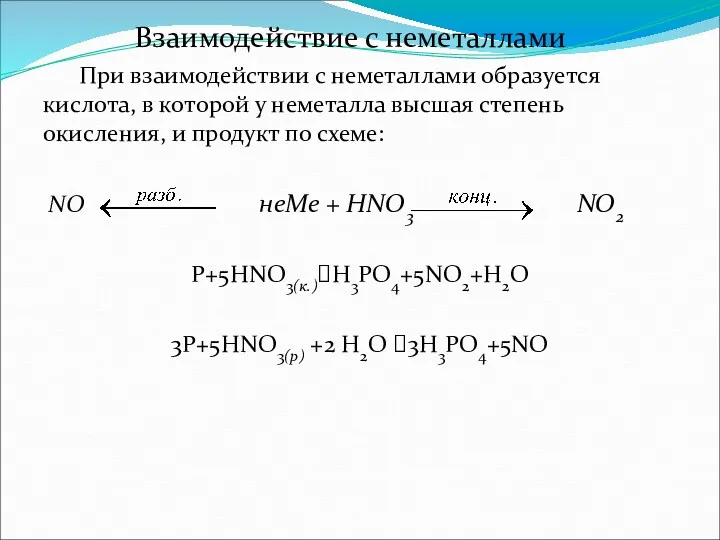
- 14. Взаимодействие с неметаллами При взаимодействии с неметаллами образуется кислота, в которой у неметалла высшая степень окисления,
- 15. Применение Азотной кислоты: - производство азотных и комбинированных удобрений, -взрывчатых веществ (тринитротолуола и др.), -органических красителей.
- 16. Проверь себя: 1. Молекулярная формула азотной кислоты: а) HNO2 б) HNO3 в) NH3 г) NH4OH 2.Степень
- 17. вывод: 1. Азотной кислоте характерны общие свойства кислот: взаимодействие с оксидами металлов, гидроксидами, солями более слабых
- 18. Домашнее задание. П 26 стр. 119-121читать рассмотреть уравнение реакции концентрированной азотной кислоты с фосфором с точки
- 20. Скачать презентацию














 Metode electrochimice. Generalităţi
Metode electrochimice. Generalităţi Кількість речовини
Кількість речовини Кислоты в животном и растительном мире
Кислоты в животном и растительном мире Химия өнеркәсібіндегі энергетикалық ресурстар
Химия өнеркәсібіндегі энергетикалық ресурстар Оксид серы (IV). Сернистая кислота и её соли
Оксид серы (IV). Сернистая кислота и её соли Занимательная химия. Химический элемент. 8 класс
Занимательная химия. Химический элемент. 8 класс Свойства простых веществ в свете ОВР
Свойства простых веществ в свете ОВР Химическое равновесие и условия его смещения
Химическое равновесие и условия его смещения Лужноземельні метали
Лужноземельні метали Химия 8 класс. Введение в химию
Химия 8 класс. Введение в химию Геохимия стабильных изотопов, Радиоуглеродный метод
Геохимия стабильных изотопов, Радиоуглеродный метод Натуральный и синтетический каучуки. Резина
Натуральный и синтетический каучуки. Резина Металлы
Металлы Способы получения металлов
Способы получения металлов Хімічні властивості кислот
Хімічні властивості кислот Теплові прояви механічної, електричної та хімічної енергії
Теплові прояви механічної, електричної та хімічної енергії α-Аминокислоты и белки
α-Аминокислоты и белки Алкадиены. Актуализация ранее полученных знаний
Алкадиены. Актуализация ранее полученных знаний Бериллий, магний и щелочноземельные металлы. Главная подгруппа II группы
Бериллий, магний и щелочноземельные металлы. Главная подгруппа II группы Металлы
Металлы Алюминий
Алюминий Темір және оның маңызды қосылыстары
Темір және оның маңызды қосылыстары Строение и свойства металлов. Физические и механические свойства металлов
Строение и свойства металлов. Физические и механические свойства металлов Энергетика химических процессов. Термодинамика. (Лекция 4)
Энергетика химических процессов. Термодинамика. (Лекция 4) Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Минералы. Классификация
Минералы. Классификация Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Сополимеры в стоматологии
Сополимеры в стоматологии