Содержание
- 2. Майже все, що оточує людину, можна описати кількісними характеристиками Як порахувати 1 200 тістечок для всіх
- 3. Майже все, що оточує людину, можна описати кількісними характеристиками Потрібно знати, скільки тістечок у коробці і
- 4. При проведенні хімічних реакцій хімікам важливо знати співвідношення реагуючих речовин із тим, щоб при проходженні реакції
- 5. Кількість речовини – це фізична величина, яка показує, скільки найменших частинок (атомів, молекул, йонів) даної речовини
- 6. Скільки структурних частинок містить один моль речовини?
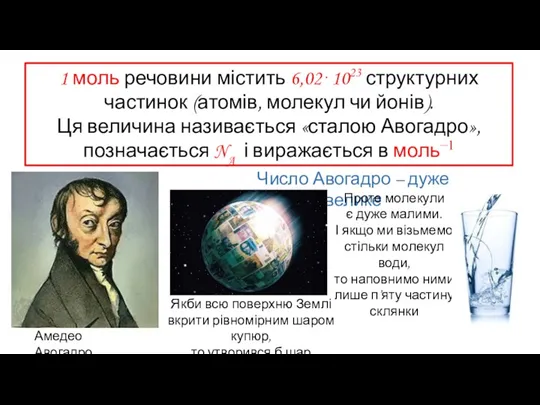
- 7. 1 моль речовини містить 6,02⋅1023 структурних частинок (атомів, молекул чи йонів). Ця величина називається «сталою Авогадро»,
- 8. Чому саме таке число обране для визначення моля?
- 9. 1 моль – це кількість речовини, що містить стільки ж структурних частинок, скільки міститься атомів у
- 10. Чи буде однаково виглядати 1 моль різних речовин?
- 11. Цукор 342 г Різні речовини кількістю речовини 1 моль Маса і об’єм 1 моль різних речовин
- 12. 2Н2 + O2 = 2Н2О 2 моль водню 1 моль кисню 2 моль води 4 моль
- 13. Розглянемо приклади задач Формули, що їх будемо використовувати, слід запамятати! N = ν • NА де
- 14. Задача 1. Скільки атомів Фосфору міститься у зразку червоного фосфору кількістю речовини 0,5 моль? Дано: ν
- 15. Задача 2. У кімнаті міститься 2,76 ⋅1026 молекул кисню. Визначте кількість речовини кисню у кімнаті. Дано:
- 16. Задача 3 . Визначте число атомів Оксигену і Гідрогену, що містяться у 5 моль води. Дано:
- 17. Задача 4. Скільки атомів Сульфуру містить 2 моль сірки? Дано: ν (S) = 2 моль Знайти:
- 18. Задача 5. Скільки молекул містить порція води кількістю речовини 3 моль? Дано: ν (Н2О) = 3
- 19. Задача 6. Скільки атомів Р і О і молекул міститься у фосфор(V) оксиді Р2О5 кількістю речовини
- 20. Підведемо підсумки! Кількість речовини – це фізична величина, яка показує, скільки найменших частинок (атомів, молекул, йонів)
- 22. Скачать презентацию


















 Алкины
Алкины Валентные возможности атомов. Степень окисления
Валентные возможности атомов. Степень окисления Металлы (11 класс)
Металлы (11 класс) Спирти. Загальні відомості про спирти
Спирти. Загальні відомості про спирти Строение атома. 8 класс
Строение атома. 8 класс Chemical Formulas and Nomenclature of compounds
Chemical Formulas and Nomenclature of compounds Химия элементов VIIA группы
Химия элементов VIIA группы Получение спиртов. Применение
Получение спиртов. Применение Вольфрам — химический элемент
Вольфрам — химический элемент Минералогия литофильных редких элементов. Бериллий
Минералогия литофильных редких элементов. Бериллий Законы химии. Классы неорганических соединений
Законы химии. Классы неорганических соединений Основные особенности композитов по сравнению с традиционными материалами
Основные особенности композитов по сравнению с традиционными материалами Алкины — углеводороды, содержащие тройную связь между атомами углерода
Алкины — углеводороды, содержащие тройную связь между атомами углерода Медь
Медь Получение пресной и чистой воды
Получение пресной и чистой воды Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс
Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс Валентность. Определение валентности по формулам. Химия. 8 класс
Валентность. Определение валентности по формулам. Химия. 8 класс Химическая связь
Химическая связь Внесение минеральных удобрений
Внесение минеральных удобрений Реактор получения элементарной серы
Реактор получения элементарной серы Sm-Nd метод
Sm-Nd метод Ізомери у природі
Ізомери у природі Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Растворы
Растворы Нанотехнологии и Наноматериалы
Нанотехнологии и Наноматериалы Классификации, номенклатура, строение и свойства органических соединений
Классификации, номенклатура, строение и свойства органических соединений Полиэтилен
Полиэтилен Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу
Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу