Содержание
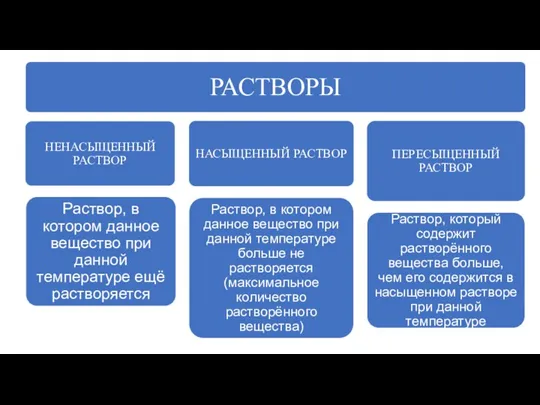
- 2. Раствор - это однородная система, в которой одно вещество распределено в среду другого (других) веществ. Непостоянство
- 3. Обычно растворителем считают тот компонент, который в чистом виде существует в том же агрегатном состоянии, что
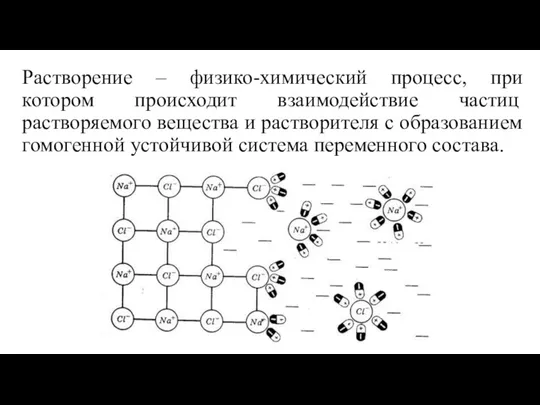
- 4. Растворение – физико-химический процесс, при котором происходит взаимодействие частиц растворяемого вещества и растворителя с образованием гомогенной
- 5. Тепловые явления при растворении. Для того, чтобы разорвать связь, нужно потратить энергию. Обычно при растворении первая
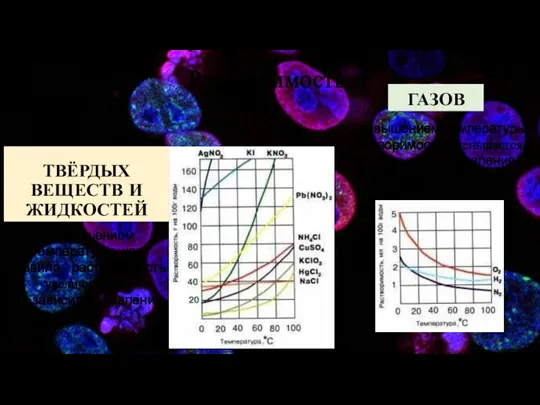
- 7. Растворимость ТВЁРДЫХ ВЕЩЕСТВ И ЖИДКОСТЕЙ ГАЗОВ С повышением температуры растворимость уменьшается С повышением давления увеличивается С
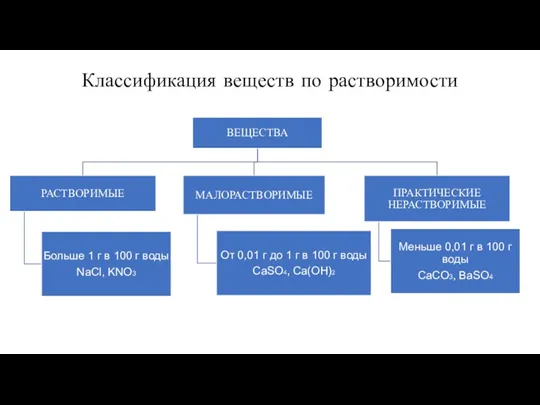
- 8. Классификация веществ по растворимости
- 10. ОБРАЗОВАНИЕ КРИСТАЛЛОВ ХЛОРИДА КАЛИЯ (KCl) В ЕГО ПЕРЕСЫЩЕННОМ РАСТВОРЕ
- 11. При взаимодействии растворенного вещества с водой образуются гидраты. Гидраты – непрочные соединения веществ с водой, существующие
- 12. Молярная концентрация или молярность – это количество моль растворённого вещества в одном литре раствора V: Раствор
- 13. Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе
- 14. Мольная доля растворённого вещества – безразмерная величина, равная отношению количества растворенного вещества n к общему количеству
- 15. Объемная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы
- 16. Самостоятельная работа 1.Определите молярную концентрацию хлорида натрия в 24%-ном растворе его плотностью 1,18 г/мл? 2. Определите
- 17. 1. Ответ - 4,84 М 2. Ответ - 6М 3. Ответ - 5,62 М 4. Ответ
- 19. Скачать презентацию












 Дослідження якісного складу солей. Практична робота №1
Дослідження якісного складу солей. Практична робота №1 Арены. Бензол. Урок химии. 10 класс
Арены. Бензол. Урок химии. 10 класс Зелёная химия
Зелёная химия Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Көпатомды спирттер. Химиялық қасиеттері
Көпатомды спирттер. Химиялық қасиеттері Свойства органических соединений
Свойства органических соединений Коллигативные свойства растворов
Коллигативные свойства растворов Драгоценные камни
Драгоценные камни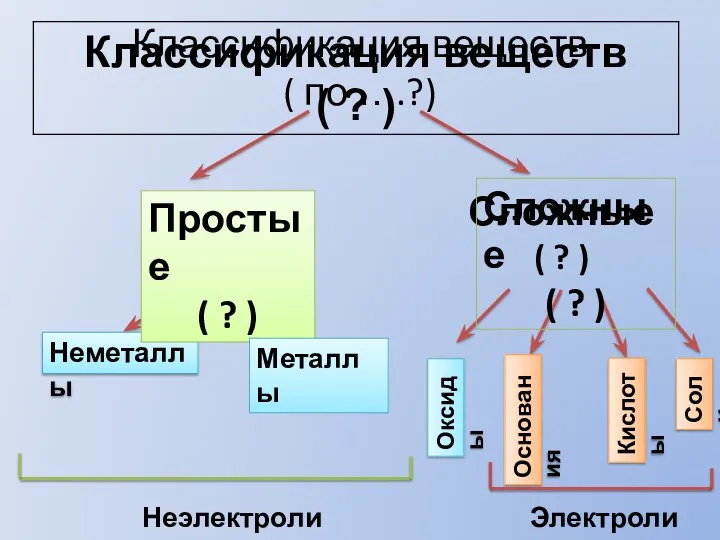 Классификация веществ
Классификация веществ Титриметрический анализ
Титриметрический анализ Минералды тыңайтқыштар өндірісі
Минералды тыңайтқыштар өндірісі Білки як високомолекулярні сполуки
Білки як високомолекулярні сполуки Аминокилоты. Свойства
Аминокилоты. Свойства Синтетические моющие средства
Синтетические моющие средства Закономерности химических реакций. (Лекция 3)
Закономерности химических реакций. (Лекция 3) Вода на Земле. Строение молекулы воды
Вода на Земле. Строение молекулы воды Адсорбция. Механизм адсорбции
Адсорбция. Механизм адсорбции Относительная молекулярная масса вещества. Задачи
Относительная молекулярная масса вещества. Задачи Основные понятия и законы химии
Основные понятия и законы химии Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Амины. Понятие об аминах. Анилин как органическое основание
Амины. Понятие об аминах. Анилин как органическое основание Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Арены
Арены Липиды (Жиры)
Липиды (Жиры) Водород. Общая характеристика, получение, свойства
Водород. Общая характеристика, получение, свойства Ұшқыш уларды оқшаулауды теориялық негіздеу
Ұшқыш уларды оқшаулауды теориялық негіздеу Капиллярная конденсация
Капиллярная конденсация Количественное определение лекарственных веществ
Количественное определение лекарственных веществ