Содержание
- 2. Девиз урока
- 3. Цель урока Повторить химические свойства оксидов, кислот, оснований , солей. Рассмотреть уравнения реакций в свете окислительной-восстановительной
- 4. Химические свойства оксидов Вспомните, с какими веществами взаимодействуют оксиды? Основные оксиды С кислотами С водой С
- 5. Химические свойства основных оксидов Взаимодействуют с кислотами +2 -2 +1 +6 -2 t +2 +6 -2
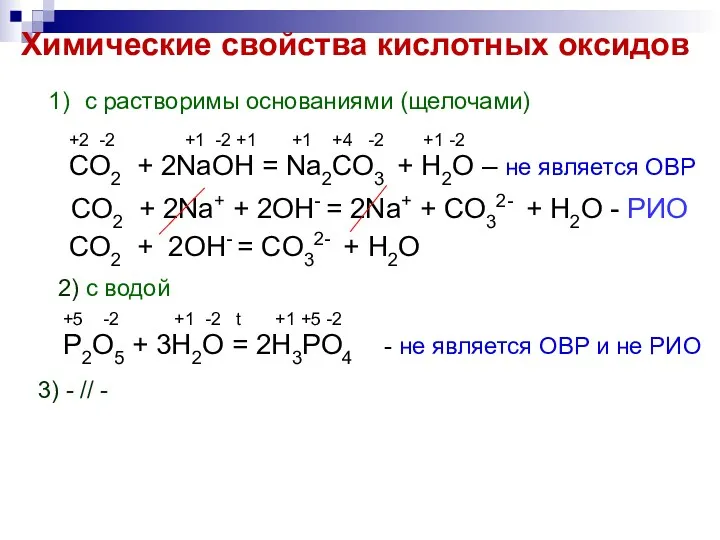
- 6. Химические свойства кислотных оксидов с растворимы основаниями (щелочами) +2 -2 +1 -2 +1 +1 +4 -2
- 7. Химические свойства кислот Вспомните, с какими веществами взаимодействуют кислоты ? с металлами с основными оксидами с
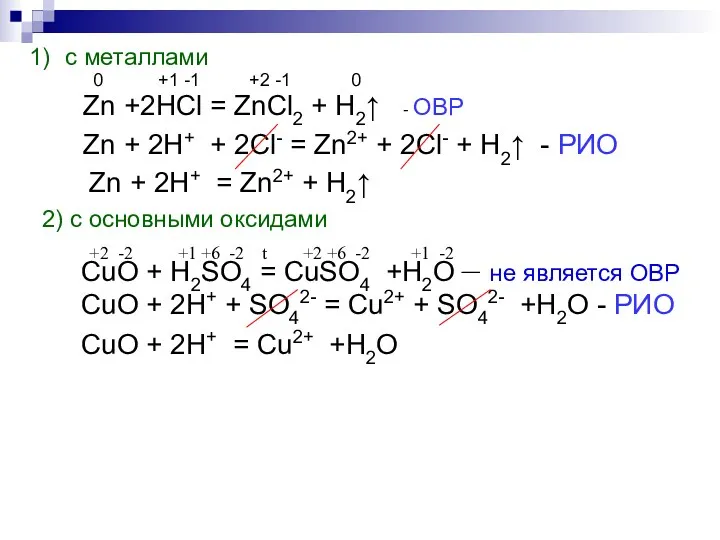
- 8. с металлами 0 +1 -1 +2 -1 0 Zn +2HCl = ZnCl2 + H2↑ - ОВР
- 9. +1 -2 -1 +1 -1 +1 -1 +1 -2 NaOH + HCl = NaCl + H2O
- 10. Вариант 1 Fe + H2SO4 = HNO3+ CuO = HCl + Zn (OH)2 = H2SO4 +
- 11. Вариант 1 Fe + H2SO4 = FeSO4 + H2 HNO3+ CuO = Cu(NO3)2 + H2O HCl
- 12. Химические свойства оснований Вспомните, с какими веществами взаимодействуют основания? с кислотами растворимые основания (щелочи) с солями
- 13. Химические свойства оснований с кислотами +1 -2 +1 +1 +6 -2 +1 +6 -2 +1 -2
- 14. Химические свойства оснований 3) Растворимые основания (щелочи) с кислотными оксидами +1 -2 +1 +6 -2 +1
- 15. Химическая свойства солей Вспомните, с какими веществами взаимодействуют соли? с металлами с кислотами с растворимыми основаниями
- 16. Химические свойства солей с металлами 0 +2 +6 -2 +2 +6 -2 0 Fe + CuSO4
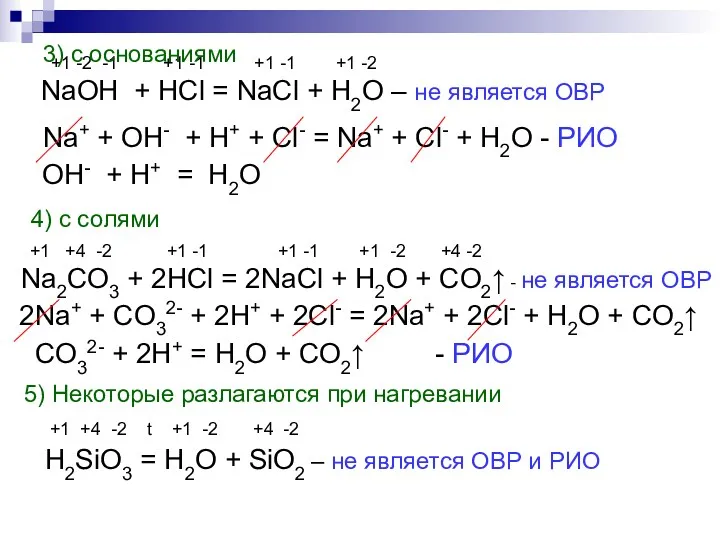
- 17. Химические свойства солей 3) с растворимыми основаниями (щелочами) +2 -1 +1 -2 +1 +1 -1 +2
- 18. Химические свойства солей 5) с кислотными оксидами +2 +4 -2 +4 -2 t +2 +4 -2
- 19. ГИА-9 (№22) Даны вещества: Mg, HNO3, Ba(NO3)2, HCl, AgNO3 . Используя воду и необходимые вещества только
- 20. Самопроверка 1) Mg + 2HCl = MgCl2 + H2↑ 2) MgCl2 + 2 AgNO3 = Mg(NO3)2
- 21. ГИА (№21) Какая масса осадка образуется при взаимодействии избытка раствора хлорида бария с 200 г раствора
- 22. Самопроверка Дано: mр-ра(Al2(SO4)3)= 200г ω (Al2(SO4)3) =10,4% m( BaSO4 ) - ? Решение: Al2(SO4)3 + 3BaCl2
- 23. Домашнее задание Повторить химические свойства неорганических соединений, §9, зад.6 Дополнительно для желающих (раздать карточки)
- 24. МОЛОДЦЫ! Вы успешно справились с работой!
- 25. Дополнительное д/з 1) Бесцветный прозрачный раствор способен изменить окраску фенолфталеина на малиновую. И пропускание через раствор
- 26. Дополнительное задание (ОГЭ-2020, №23) В трех колбах находятся растворы веществ: хлорида железа (II), хлорида магния и
- 28. Скачать презентацию






















 Классификация химических элементов
Классификация химических элементов Азотная кислота. Соли азотной кислоты. Получение и применение (9 класс)
Азотная кислота. Соли азотной кислоты. Получение и применение (9 класс) Алкины. Непредельные углеводороды
Алкины. Непредельные углеводороды Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды Химические элементы в организме человека
Химические элементы в организме человека Обратимость химических реакций. Химическое равновесие и способы его смещения
Обратимость химических реакций. Химическое равновесие и способы его смещения Непредельные углеводороды
Непредельные углеводороды Химические свойства получение и применение солей
Химические свойства получение и применение солей Роль хімії в природі
Роль хімії в природі Кислоты. Состав и классификация кислот. Формулы и названия основных неорганических кислот
Кислоты. Состав и классификация кислот. Формулы и названия основных неорганических кислот Кислотно-основные равновесия. Введение в титриметрию
Кислотно-основные равновесия. Введение в титриметрию Фтор (Fluorum), F
Фтор (Fluorum), F Опасности среды обитания человека
Опасности среды обитания человека Строение атома. Химическая связь
Строение атома. Химическая связь Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Факторы и процессы формирования химического состава подземных вод
Факторы и процессы формирования химического состава подземных вод Лекция Атомное строение твердых тел. 1-01
Лекция Атомное строение твердых тел. 1-01 Геохимия метасоматтческого процесса. (Лекция 7)
Геохимия метасоматтческого процесса. (Лекция 7) Соединения химических элементов. Валентность и степень окисления элементов
Соединения химических элементов. Валентность и степень окисления элементов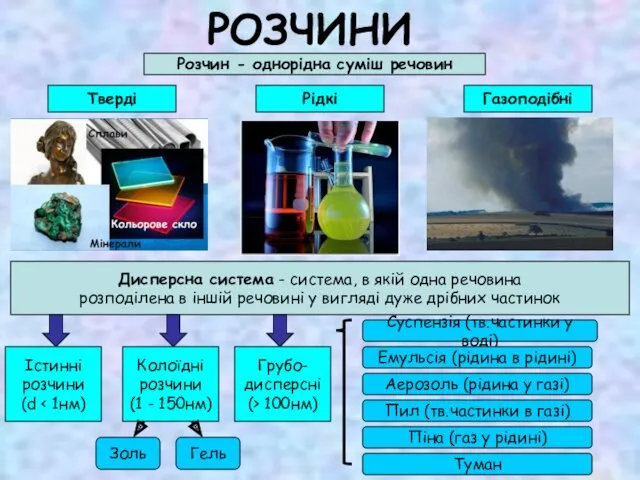 Розчини
Розчини Открытие периодического закона
Открытие периодического закона Азотсодержащие соединения. Амины. Аминокислоты
Азотсодержащие соединения. Амины. Аминокислоты Основные характеристики различных сортов меда
Основные характеристики различных сортов меда Тыңайтқышты тиімді пайдалансақ
Тыңайтқышты тиімді пайдалансақ Волшебные кристалы
Волшебные кристалы М.В.Ломоносов о пользе стекла
М.В.Ломоносов о пользе стекла Взаимодействия кислорода с металлом
Взаимодействия кислорода с металлом Электоролиз заңы
Электоролиз заңы