Содержание
- 2. Азотная кислота. Соли азотной кислоты. Получение и применение азотной кислоты
- 3. Историческая справка Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса: 4KNO3 + 2(FeSO4
- 4. Характеристика HNO3
- 5. Азотная кислота - Формула: HNO3 Структурная формула: Валентность азота: IV Степень окисления: +5
- 6. Физические свойства Бесцветная Дымящая на воздухе жидкость С резким запахом Кипит при 83° При попадании на
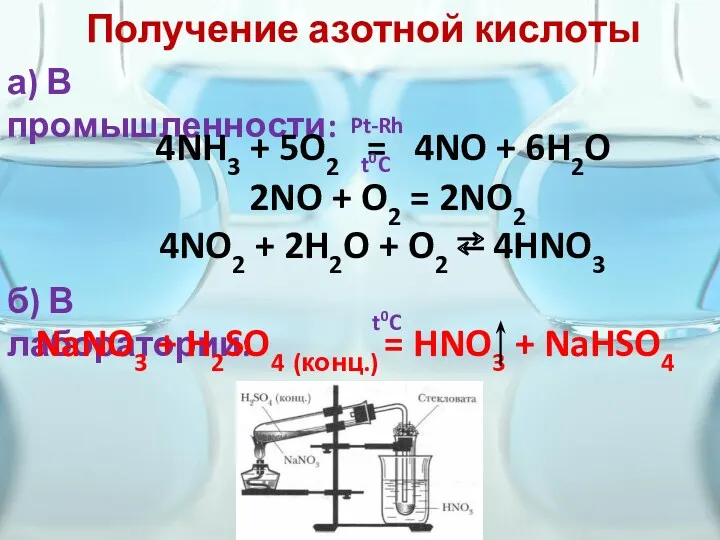
- 7. Получение азотной кислоты а) В промышленности: 4NH3 + 5O2 = 4NO + 6H2O Pt-Rh t0C 2NO
- 8. Промышленная схема получения азотной кислоты
- 9. Химические свойства азотной кислоты 1. Общие свойства кислот (раствор): HNO3 → H+ + NO3- CuO +
- 10. 2. Сильный окислитель 4HNO3 (разб.) + 3Ag = 3AgNO3 + NO + 2H2O 4HNO3 (конц.) +
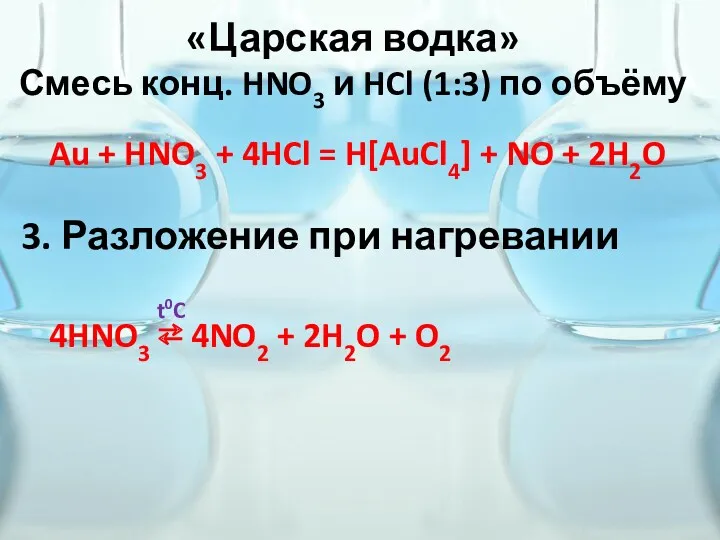
- 11. «Царская водка» Смесь конц. HNO3 и HCl (1:3) по объёму Au + HNO3 + 4HCl =
- 12. 4. Взаимодействие металлов с HNO3 Практически никогда не выделяется Н2!!! При нагревании взаимодействуют все металлы, кроме
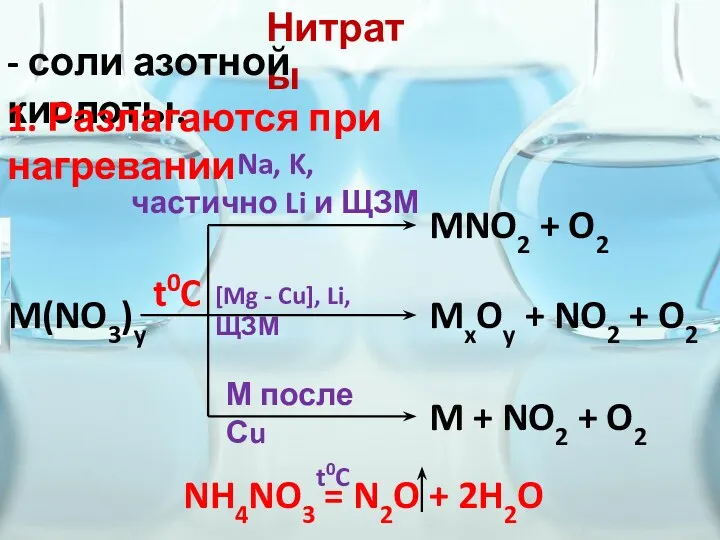
- 13. Нитраты - соли азотной кислоты. 1. Разлагаются при нагревании M(NO3)y MNO2 + O2 t0C MxOy +
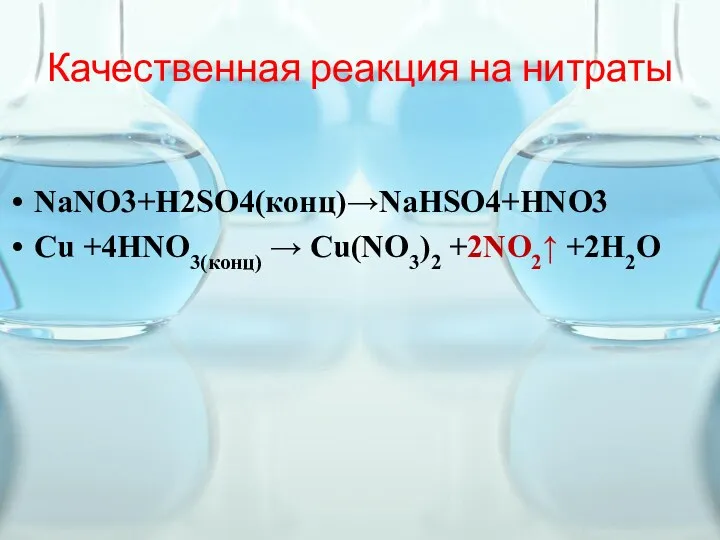
- 15. Качественная реакция на нитраты NaNO3+H2SO4(конц)→NaHSO4+HNO3 Cu +4HNO3(конц) → Cu(NO3)2 +2NO2↑ +2H2O
- 16. 2. Сильные окислители (твёрдые, при t) NaNO3 + Pb = NaNO2 + PbO 2KNO3 + 3C
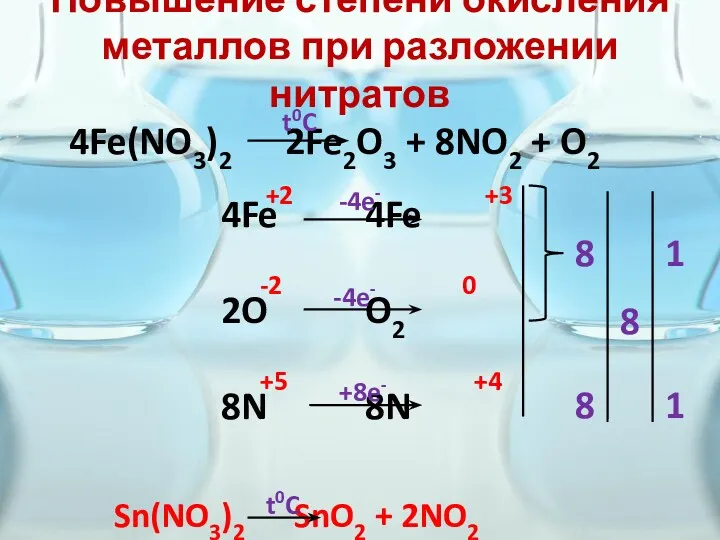
- 17. Повышение степени окисления металлов при разложении нитратов 4Fe(NO3)2 2Fe2O3 + 8NO2 + O2 4Fe 4Fe 2O
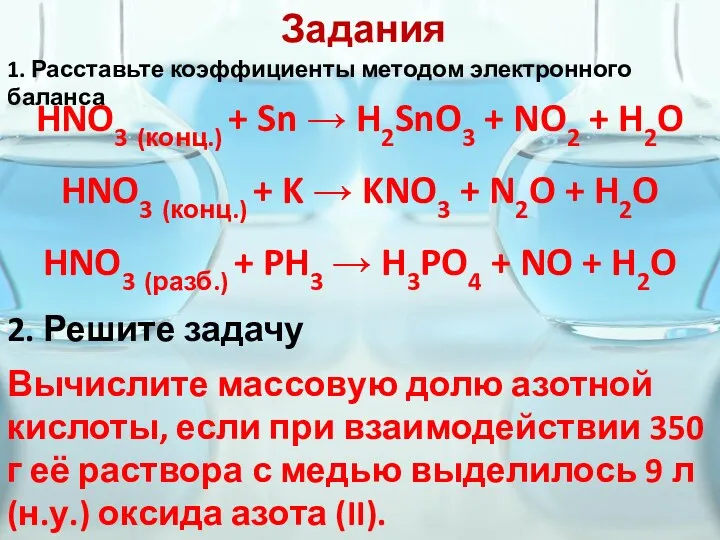
- 18. Задания 1. Расставьте коэффициенты методом электронного баланса HNO3 (конц.) + Sn → H2SnO3 + NO2 +
- 19. Домашнее задание §27, упр.2,3(п) §28 упр.3(п)
- 20. Фосфор и его соединения. 2.04.21
- 21. Фосфор и его соединения. План конспекта:
- 23. Скачать презентацию














 Галогены. Фтор, хлор, бром, йод, астат
Галогены. Фтор, хлор, бром, йод, астат Пропилен-алкены(пропен)
Пропилен-алкены(пропен) Теория строения органических соединений
Теория строения органических соединений Электролитическая диссоциация. Реакции ионного обмена
Электролитическая диссоциация. Реакции ионного обмена 20230205_okislitelno-_vosstanovitelnye_reaktsii
20230205_okislitelno-_vosstanovitelnye_reaktsii Скорость химических реакций. Катализ. Химическое равновесие
Скорость химических реакций. Катализ. Химическое равновесие Соли. Классификация. Физические и химические свойства солей
Соли. Классификация. Физические и химические свойства солей Current Condition(Revision C)
Current Condition(Revision C) Состояние электронов в атоме
Состояние электронов в атоме Измерение и оценка химического фактора. Лекция 9
Измерение и оценка химического фактора. Лекция 9 Фосфор и его соединения
Фосфор и его соединения Прочность полимеров
Прочность полимеров Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Бензол молекуласында байланыстардың түзілу сызбанұсқасы
Бензол молекуласында байланыстардың түзілу сызбанұсқасы Полімери. Їх властивості та застосування
Полімери. Їх властивості та застосування Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Щелочные металлы
Щелочные металлы Типы эмульсий. Фракционный состав нефти. Типы нефти
Типы эмульсий. Фракционный состав нефти. Типы нефти Счастливый случай. Право первого хода
Счастливый случай. Право первого хода Газообразные вещества
Газообразные вещества Химическая коррозия. Методы защиты от химической коррозии
Химическая коррозия. Методы защиты от химической коррозии Алкины. Гомологический ряд
Алкины. Гомологический ряд Теория строения органического вещества. 10 класс
Теория строения органического вещества. 10 класс Самое удивительное на свете вещество - вода
Самое удивительное на свете вещество - вода АЛКАНЫ Строение молекулы метана.
АЛКАНЫ Строение молекулы метана. Сапалық талдау. Сапалық аналитикалық реакциялар
Сапалық талдау. Сапалық аналитикалық реакциялар Кислород. Химия. 8 класс
Кислород. Химия. 8 класс Физические свойства металлов
Физические свойства металлов