Содержание
- 2. Закон триад В 1817 году немецкий химик Иоганн Вольфганг Доберейнер на основе сходства химической природы некоторых
- 3. Закон октав 18 августа 1865 года Джон Александр Рейна Ньюлендс опубликовал таблицу элементов, назвав её «законом
- 4. 1 марта 1866 года Ньюлендс сделал доклад «Закон октав и причины химических соотношений среди атомных весов»
- 5. В марте 1869 г. русский химик Дмитрий Иванович Менделеев представил Русскому химическому обществу, периодический закон химических
- 6. 1. Элементы, расположенные по возрастанию их атомного веса, представляют явственную периодичность свойств; 2. Сходные по свойствам
- 8. «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости
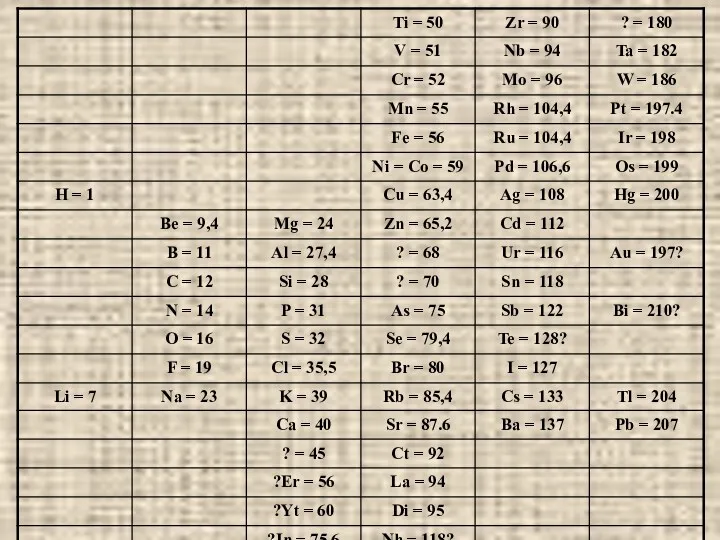
- 9. В конце 1870 г. Менделеев доложил РХО статью «Естественная система элементов и применение её к указанию
- 10. «Нет никакого сомнения, что в скандии открыт экабор. Так подтверждаются самым наглядным образом мысли русского химика,
- 11. В 1886 году один из профессоров Фрейбергской горной академии открыл новый минерал серебра – аргиродит. Этот
- 14. «Вряд ли может существовать более яркое доказательство справедливости учения о периодичности элементов, чем открытие до сих
- 15. ПЕРИОДИЧЕСКАЯ ЗАВИСИМОСТЬ СВОЙСТВ ПРОСТЫХ ВЕЩЕСТВ
- 16. В таблице – более 100 элементов В 2000 открыт 114 элемент- путем бомбардировки на циклотроне У-400
- 17. Современная формулировка закона: свойства простых веществ, а также формы и свойства их соединений элементов находятся в
- 18. Свойства элементов определяются: зарядом ядра его атомов атомным радиусом - числом электронов на внешней оболочке
- 19. Атомный номер элемента (физический смысл): Атомный номер элемента показывает заряд ядра элемента, число протонов, число электронов
- 20. Периоды – горизонтальные ряды таблицы. Малые (2 – в I или 8 – во II и
- 21. Периодические закономерности Горизонтальная Вертикальная Диагональная
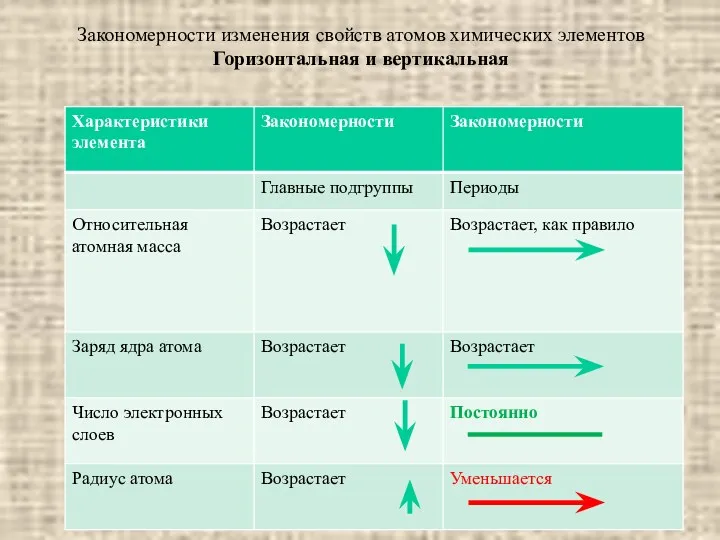
- 22. Закономерности изменения свойств атомов химических элементов Горизонтальная и вертикальная
- 23. Закономерности связанные с валентностью Валентность - способность атомов элементов образовывать определённое число химических связей с атомами
- 24. Электроотрицательность – количественная характеристика способности атома притягивать к себе электроны от атомов других элементов
- 25. Электроотрицательность - способность атома в молекуле или сложном ионе притягивать к себе электроны, участвующие в образовании
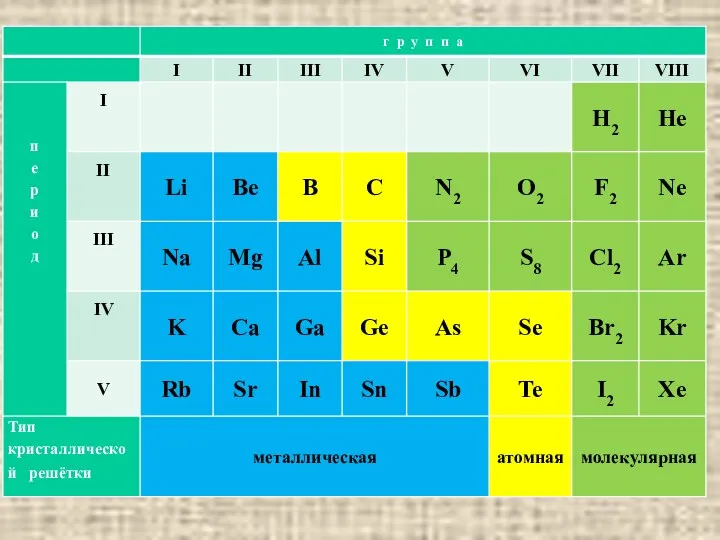
- 26. Кристаллические решетки веществ – упорядоченное расположение частиц (атомов, ионов, молекул) в строго определенных точках пространства. Точки
- 27. МЕТАЛЛИЧЕСКАЯ – в узлах ионы металла, валентные электроны обеспечивают связь. Пластичность, электропроводность, теплопроводность. ИОННАЯ – вещества
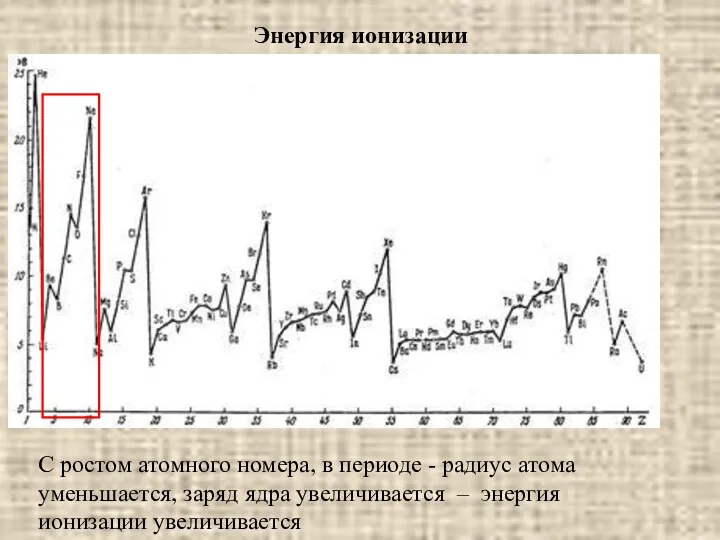
- 29. Энергия ионизации С ростом атомного номера, в периоде - радиус атома уменьшается, заряд ядра увеличивается –
- 30. Горизонтальная закономерность – в периоде с ростом порядкового номера металлические свойства ослабевают, неметаллические усиливаются. Вертикальная закономерность
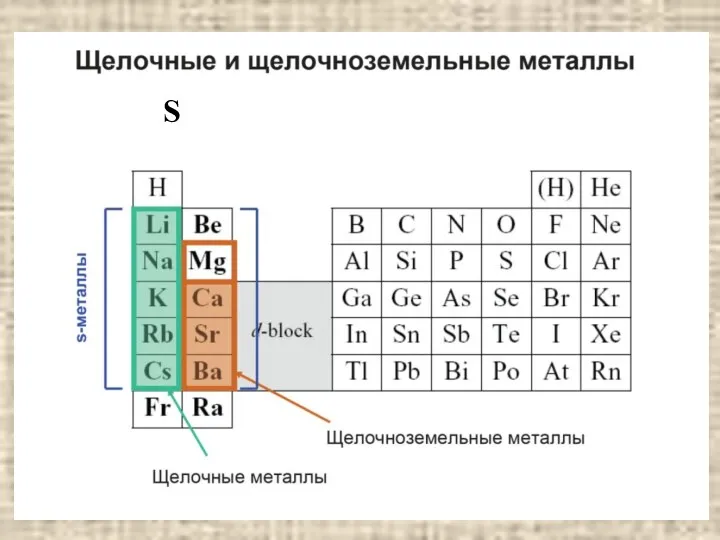
- 31. S
- 33. Скачать презентацию

























 Обмен липидов
Обмен липидов Органическая химия. Пособие
Органическая химия. Пособие Комплексные соединения
Комплексные соединения Каучук и резина
Каучук и резина Алкены. Этилен, его получение
Алкены. Этилен, его получение 20230306_vodorod_ego_fizicheskie_svoystva
20230306_vodorod_ego_fizicheskie_svoystva Возникновение двойного электрического слоя
Возникновение двойного электрического слоя NPK Fertilizers. Classification of fertilizers
NPK Fertilizers. Classification of fertilizers Введение в химию гетероциклических соединений
Введение в химию гетероциклических соединений Простые спектры 1Н ЯМР
Простые спектры 1Н ЯМР Металдар мен бейметалдардың салыстырмалы сипаттамасы
Металдар мен бейметалдардың салыстырмалы сипаттамасы Химический элемент алюминий
Химический элемент алюминий Химическая связь. Ковалентная связь
Химическая связь. Ковалентная связь Современные тенденции развития химии
Современные тенденции развития химии Водород
Водород Типы химических реакций
Типы химических реакций Соединения углерода
Соединения углерода 20230814_obobshchenie_po_teme_nemetally
20230814_obobshchenie_po_teme_nemetally Закон постоянства состава вещества
Закон постоянства состава вещества Фосфор и его соединения
Фосфор и его соединения Азотная кислота
Азотная кислота Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Интеллектуальная игра Кто хочет стать отличником?. Химия. 11 класс
Интеллектуальная игра Кто хочет стать отличником?. Химия. 11 класс Історичні відомості про спроби класифікації хімічних елементів. Відкриття періодичного закону Д.І. Менделєєва
Історичні відомості про спроби класифікації хімічних елементів. Відкриття періодичного закону Д.І. Менделєєва Максимально очищенные фитопрепараты. Технология и стандартизация
Максимально очищенные фитопрепараты. Технология и стандартизация Диаграмма железо-углерод
Диаграмма железо-углерод Стирка по научному
Стирка по научному Протеины: плюсы и минусы
Протеины: плюсы и минусы