Слайд 2

III период, V группа,
главная подгруппа
Степени окисления: -3, +3, +5
Р2О5 – высший
оксид (кислотный)
РН3 – летучее водородное
соединение
Слайд 3
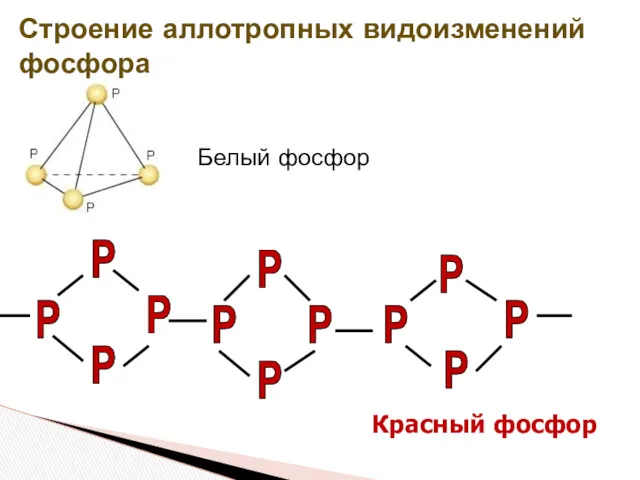
Строение аллотропных видоизменений фосфора
Красный фосфор
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Белый фосфор
Слайд 4

Красный фосфор Белый фосфор
Слайд 5

Химические свойства
1) Красный фосфор при нагревании переходит в белый и
наоборот.
Фосфор – восстановитель:
2) 5О2 (изб.) + 4Р = 2Р2О5
3О2 (недост.) + 4Р = 2Р2О3
3) 3Сl2 + 2P = 2PCl3 PСl3 + Cl2 = PCl5
4) 3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
5) 6P + 12H2O = 3H3PO4 + 5РH3↑
6) Фосфор – окислитель:
2Р + 3Mg = Mg3P2
Слайд 6

Получение
Фосфор получают из фосфоритов и апатитов, нагревая их в электрической печи
без доступа воздуха в присутствии оксида кремния (IV) и угля
Са3(РО4)2+5С+3SiO2 t 3CaSiO3+2P+5CO
пары фосфора конденсируются под водой, и при этом образуется белый фосфор, в узлах кристаллической решётки которого находятся молекулы Р4.
Слайд 7

Кислотный оксид Р2О5
Физические свойства
Белое гигроскопичное порошкообразное вещество.
Хорошо растворимое в воде,
образует несколько кислот.
Используется как осушитель газов и жидкостей, отнимает воду у химических соединений.
Слайд 8

Кислотный оксид Р2О5
Химические свойства
1) с водой
Р2О5 + 3 Н2О =
2Н3РО4
(ортофосфорная кислота)
Р2О5 + Н2О = 2НРО3
(метафосфорная кислота)
Р2О5 + 2 Н2О = Н4Р2О7
(пирофосфорная кислота)
Слайд 9

Кислотный оксид Р2О5
Химические свойства
2) с основными оксидами
Р2О5 + 3 СаО =
Са3 (РО4)2
3) со щелочами
Р2О5 + 6 NаОН = 2 Nа3РО4 + 3 Н2О
Слайд 10

Ортофосфорная кислота Н3РО4
Физические свойства
Белые прозрачные кристаллы,
не ядовита
Кислота средней силы
С водой смешивается в любых соотношениях.
Тплав. = 42 0С, плавиться без разложения, при умеренном нагревании разлагается.
Окислительные свойства не проявляет (отличие от Н2SO4 (конц.), НNO3)
Слайд 11

Ортофосфорная кислота Н3РО4
Физические свойства
Белые прозрачные кристаллы,
не ядовита
Кислота средней силы
С водой смешивается в любых соотношениях.
Тплав. = 42 0С, плавиться без разложения, при умеренном нагревании разлагается.
Окислительные свойства не проявляет (отличие от Н2SO4 (конц.), НNO3)
Слайд 12

Ортофосфорная кислота Н3РО4
Является трехосновной кислотой и образует три ряда солей:
1) средние
соли, или фосфаты - Са3 (РО4)3
Которые нерастворимы в воде, кроме фосфатов щелочных металлов
2) Кислые-дигидрофосфаты- Са(Н2РО4)2
Большинство из которых хорошо растворимы в воде
Слайд 13

Ортофосфорная кислота Н3РО4
3) Кислые-гидрофосфаты- СаНРО4
Которые малорастворимы в воде (кроме фосфатов
натрия, калия и аммония), т.е. занимают промежуточное положение между фосфатами и дигидрофосфатами по растворимости.
Вывод: с увеличением содержания атомов водорода в молекуле соли, ее растворимость повышается.
Слайд 14

Ортофосфорная кислота Н3РО4
Химические свойства
Н3РО4 проявляет все свойства кислот
Реагирует:
1) со
щелочами: NaOH, КОН
2) с основными оксидами: Li2O, Na2O
3) c солями: К2СО3
4) Некоторые реакции с металлами протекают в очень разбавленных растворах:
2 Н3РО4 (разб) + 3 Мg = Мg3(РО4 )2↓ + 3Н2↑
Слайд 15

Ортофосфорная кислота Н3РО4
Химические свойства
Фосфаты всех металлов (Кроме ЩМ) нерастворимы,
поэтому на поверхности этих металлов образуется нерастворимая пленка, препятствующая их дальнейшему растворению в кислоте.
ЩМе при растворении в кислоте, начинают взаимодействовать с водой.
Слайд 16

Качественная реакция
на фосфат-ион РО43-
РО43- + 3 Ag+ = Ag3РО4
↓ (желтый фосфат серебра)
Полученный осадок растворяется в сильных кислотах.
По этому признаку его можно отличить от других нерастворимых солей серебра желтого цвета – AgI, AgBr
AgCl – белого цвета
Слайд 17

Фосфор в природе
Из-за большой химической активности фосфор в природе встречается
только в соединениях.
Фосфор входит в состав:
Минералов фосфоритов и апатитов, в виде соединения фосфата кальция Ca3 (PO4)2;
Белковых веществ, содержащихся в генеративных органах растений;
Нервной и костной тканей организмов животных и человека;
Мозговых клеток.
Слайд 18

Применение
Красный фосфор применяют в производстве спичек. Его вместе с тонко
измельченным стеклом и клеем наносят на боковую сторону коробка. При трении спичечной головки, в состав которой входят хлорат калия KClО3 и сера, происходит воспламенение:
6Р+5KClO3 5KCl+3P2O5
Белый фосфор в военное время использовали в зажигательных бомбах и для создания дымовых завес.
Слайд 19


















 Включение региональных особенностей Камчатского края в программы учебного предмета химия
Включение региональных особенностей Камчатского края в программы учебного предмета химия Basis Sets and Pseudopotentials
Basis Sets and Pseudopotentials Хімічні явища у природі
Хімічні явища у природі Гидролиз солей. Гидроксиды
Гидролиз солей. Гидроксиды Атомы, молекулы и ионы. Вещества молекулярного и немолекулярного строения
Атомы, молекулы и ионы. Вещества молекулярного и немолекулярного строения Поняття про полімери на прикладі поліетилену. Використання поліетилену
Поняття про полімери на прикладі поліетилену. Використання поліетилену Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон
Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон Фосфор. Гипофосфатемия и гиперфосфатемия
Фосфор. Гипофосфатемия и гиперфосфатемия Сполуки неметалічних елементів з Гідрогеном
Сполуки неметалічних елементів з Гідрогеном Электрометрические методы анализа ЛВ. Термографические методы
Электрометрические методы анализа ЛВ. Термографические методы Строение атома
Строение атома Нефть как дисперсная система
Нефть как дисперсная система Итоговая контрольная работа по химии
Итоговая контрольная работа по химии Получение и приминение этилена
Получение и приминение этилена Коллигативные свойства растворов
Коллигативные свойства растворов Способы разделения смесей, применяемые в быту
Способы разделения смесей, применяемые в быту Количественное определение лекарственных веществ
Количественное определение лекарственных веществ Кислоты в животном и растительном мире
Кислоты в животном и растительном мире Изучение состава чая
Изучение состава чая Нитраты в овощах и фруктах
Нитраты в овощах и фруктах Железо. Физические свойства
Железо. Физические свойства Хлориды. Химические свойства
Хлориды. Химические свойства Повітря, його склад
Повітря, його склад Химиялық өнеркәсіп
Химиялық өнеркәсіп Термический анализ
Термический анализ Ферменты. Размеры ферментов и их строение
Ферменты. Размеры ферментов и их строение Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина перша)
Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина перша) Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения