Содержание
- 2. ПРАВИЛА НАПИСАНИЯ ИКР №1 1.Можно пользоваться периодической системой химических элементов Д.И. Менделеева и таблице растворимости кислот,
- 3. ТЕМЫ, ВЫНОСИМЫЕ НА ИКР №1 1.Окислительно-восстановительные реакции. Окислитель и восстановитель. 2.Классификация химических реакций. Катализатор и его
- 4. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
- 5. 1.Материал урока №1 (от 8.09.2020). 2.Повторить, как определяются степени окисления элементов в формулах химических соединений. 3.Повторить
- 6. Из предложенного перечня химических реакций выберите ту, в которой сера является одновременно и окислителем и восстановителем.
- 7. Составьте уравнение окислительно-восстановительной реакции, схема которой: Hg + HNO3 → Hg(NO3)2 + NO + H2O Составьте
- 8. Составьте уравнение окислительно-восстановительной реакции, схема которой: PbO2 + HBr → PbBr2 + Br2 + H2O Составьте
- 9. КЛАССИФИКАЦИЯ РЕАКЦИЙ. КАТАЛИЗАТОР. ТЕПЛОВОЙ ЭФФЕКТ.
- 10. 1.Материал уроков №2-3. 2.Повторить классификацию реакций. 3.Повторить определение и особенности катализатора. 4.Повторить правила решения задач на
- 11. В соответствии с приведенным ниже уравнением химической реакции выделилось 300 кДж энергии. Ba(OH)2 + 2HNO3 =
- 12. В соответствии с приведенным ниже термохимическим уравнением химической реакции образовалось 6,72 л (при н.у.) водорода. 2Na
- 13. В соответствии с приведенным ниже термохимическим уравнением химической реакции образовалось 4,48 л (при н.у.) водорода. Zn
- 14. СКОРОСТЬ РЕАКЦИИ. ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ РЕАКЦИИ.
- 15. Во сколько раз увеличится скорость некоторой химической реакции при увеличении температуры на 20º, если температурный коэффициент
- 16. Какое воздействие на систему приведёт к увеличению скорости реакции между магнием и соляной кислотой?. Повышение температуры
- 17. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- 18. 5СO + I2O5 ↔ I2 + 5CO2 +Q газ твёрдое газ твёрдое В какую сторону (вправо
- 19. N2 + 3H2 ↔ 2NH3 +Q газ газ В какую сторону (вправо или влево) сместится равновесие
- 20. ЭЛЕКТРОЛИТЫ. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
- 21. ПОВТОРИТЬ: 1)Электролиты и их классификацию. Слабые и сильные электролиты. Неэлектролиты. 2)Уравнения электролитической диссоциации. 3)Реакции ионного обмена.
- 22. В каком ряду записаны вещества, каждое из которых является сильным электролитом? 1)Na2SO3 и HNO2 2)NO и
- 23. Наибольшее количество моль анионов образуется при диссоциации: 1)Сульфита натрия 2)Соляной кислоты 3)Гидроксида бария 4)Карбоната калия Задание
- 24. Электролитической диссоциации сульфата калия соответствует правая часть: 1) =K+ + SO42- 2) =2K+ + SO42- 3)
- 25. Напишите уравнения ступенчатой диссоциации угольной кислоты. Задание №7 РЕШЕНИЕ: H2СO3 H + HСO3 Угольная кислота –
- 26. В водном растворе не могу одновременно находиться ионы: 1) NO3- , SO42- , Na+ , Cu2+
- 27. Образование осадка не происходит при взаимодействии ионов: SO42- и Ba2+ CO32- и Сa2+ Cu2+ и OH-
- 28. Выделение газа происходит при взаимодействии ионов: SO32- и Na+ CO32- и H+ Al3+ и OH- Ca2+
- 29. ГАЛОГЕНЫ
- 30. ПОВТОРИТЬ: 1)Физические свойства галогенов. 2)Способы получения галогенов на примере хлора. 3)Химические свойства галогенов. 4)Применение галогенов и
- 31. С каким соединением не взаимодействует хлор? 1)NaOH 2)KBr 3)Al 4)O2 Задание №1 Задание №2 Из предложенного
- 32. Выберите два верных утверждения о галогенах: 1)Галогены являются неметаллами 2)Из всех галогенов фтор является самым сильным
- 34. Скачать презентацию































 Металдарға жалпы сипаттама
Металдарға жалпы сипаттама Металлы в природе. Способы получения металлов
Металлы в природе. Способы получения металлов Сущность процесса электролиза
Сущность процесса электролиза Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Химия биогенных элементов p -блока
Химия биогенных элементов p -блока Общие методические приемы в оценке качества лекарственных форм
Общие методические приемы в оценке качества лекарственных форм Кислород. Электронное строение и свойства
Кислород. Электронное строение и свойства Щелочные металлы. (9 класс)
Щелочные металлы. (9 класс) Зерттеу әдістері
Зерттеу әдістері Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Уравнения химических реакций
Уравнения химических реакций Периодический закон Д.И. Менделеева (лекция 3)
Периодический закон Д.И. Менделеева (лекция 3) Щавелевая кислота
Щавелевая кислота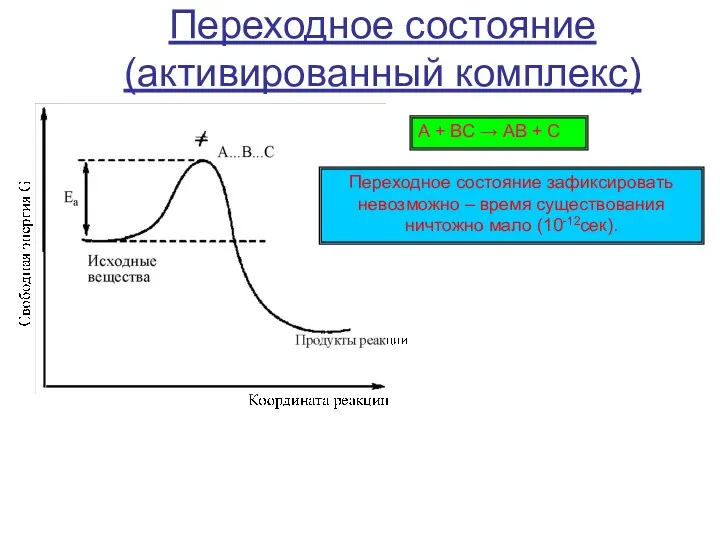 Химические свойства карбокатионов
Химические свойства карбокатионов Липиды 2. Тканевой обмен
Липиды 2. Тканевой обмен Соединения железа Fe+2 и Fe+3
Соединения железа Fe+2 и Fe+3 Металлы – простые вещества
Металлы – простые вещества Галогены VII группы. Биологическая роль и применение в медицине
Галогены VII группы. Биологическая роль и применение в медицине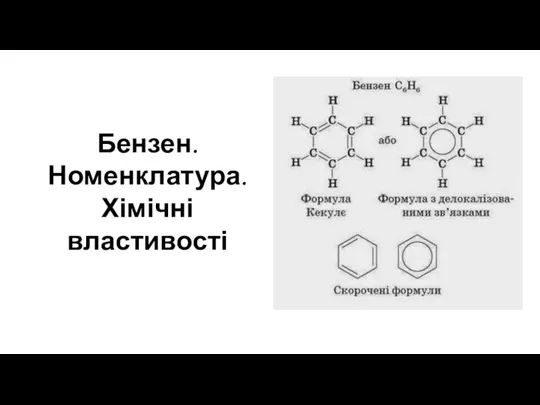 Бензен. Номенклатура. Хімічні властивості
Бензен. Номенклатура. Хімічні властивості Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Олимпиадные задачи муниципального этапа по химии
Олимпиадные задачи муниципального этапа по химии Производные морфинана (фенантренизохинолина)
Производные морфинана (фенантренизохинолина) Высокомолекулярные вещества полимеры
Высокомолекулярные вещества полимеры Сорбіт C6H14O6
Сорбіт C6H14O6 Кремний и его соединения
Кремний и его соединения Все о чае
Все о чае Chemical reactions and heat. (Chapter 1)
Chemical reactions and heat. (Chapter 1) Mercury. Mercury cycle
Mercury. Mercury cycle