Содержание
- 2. Сабақтың тақырыбы: Металдарға жалпы сипаттама Өткізілу күні:14.11.13 ж Өткізілу уақыты: 11.00 Өткізілу орны: Өскемен қаласындағы химия-биология
- 3. 1. Білімділік:Оқушылардың металдардың периодтық жүйедегі орнына кіші және үлкен период металдарының атом құрылысына тән ерекшеліктеріне көңілін
- 4. Cабақтың міндеті: Металдардың тұрмыста, өнеркәсіпте қолданылуы, құймалардың пайдасы жөнінде білімдерін дамыту, металдар туралы ұғымдарын кеңейту, танымдық
- 5. Оқытудың күтілетін нәтижелері: Металдардың периодтық жүйедегі орнына кіші және үлкен период металдарының атом құрылысына тән ерекшеліктері
- 6. Сабақ жоспары 1.Металдардың периодтық жүйедегі орыны,атом құрылысындағы ерекшеліктер 2. Металдардың табиғатта таралуы 3. Металдардың құрылысы және
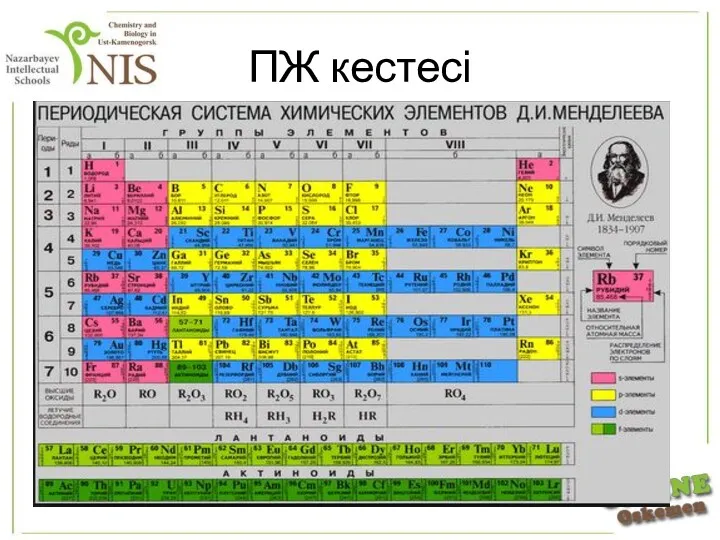
- 7. Металдардың периодтық жүйедегі орыны Бейметалдар мен металдардың периодтық кестедегі орнын «бор – кремний – мышьяк –
- 8. ПЖ кестесі
- 9. Қазақ халқының ежелден пір тұтып келе жатқан, ал химиктер мойындаған сыры жұмбақ сиқырлы санның бірі -
- 10. Тайқазан Қ.Ахмет кесенесінің негізгі орталығы, құдіреті ол-тайқазан. Тайқазан-ішіне мың литр сұйықтық сиятын,салмағы 2 тонна, биіктігі тұғырымен
- 11. Металдарға жататындар: 1. Барлық S- элементтер ( Н,Не басқа) 2. Барлық d- және f- элементтер 3.
- 12. Металдардың атом құрылысындағы ерекшеліктер: 1. S –элементтерінің валенттілік электрондарының жалпы формуласы ns 1;2 ( n= 1-7)
- 13. Металл атомдарының қасиеттерін сипаттайтын шамалар : 1. Негізгі топшадағы металдардың атом радиустары жоғарыдан төмен қарай артады,
- 14. 2. Период бойынша металл атомдарының радиусы біртіндеп кемиді, сондықтан иондану энергиясы, электронтартқыштық және электртерістілік қасиеттері артады.
- 15. 3. Қосымша топша металдары үшін, негізгі топшадағы заңдылықтар сақталады. Бірақ V және VI- периодтың металдары үшін
- 16. Металдардың табиғатта таралуы «Жері байдың – елі бай» дейді қазақ халқы. Біздің республикамыздың жер қойнауынан периодтық
- 17. Көптеген металдар табиғатта тек қосылыстар түрінде кездеседі. Табиғи қосылыстардың табиғаты металдың белсенділігіне байланысты. Металл неғұрлым белсенді
- 18. Белсенділігі біраз төмен сілтілік жер металдар суда нашар еритін сульфаттар, карбонаттар түрінде кездеседі( CaCO3- мәрмәр, CaSO4∙
- 19. Қорғасын, қалайы және қосымша топша металдарының табиғи қосылыстары - оксидтері немесе сульфидтері болып келеді. Химиялық белсенділігі
- 20. Табиғатта кездесуіне қарай металдарды бірнеше топқа бөлуге болады: Сирек кездесетін металдар:Li,Be,Cs,Rb Сиректеу кездесетін металдар:Sc,V,La, лантаноидтар Асыл
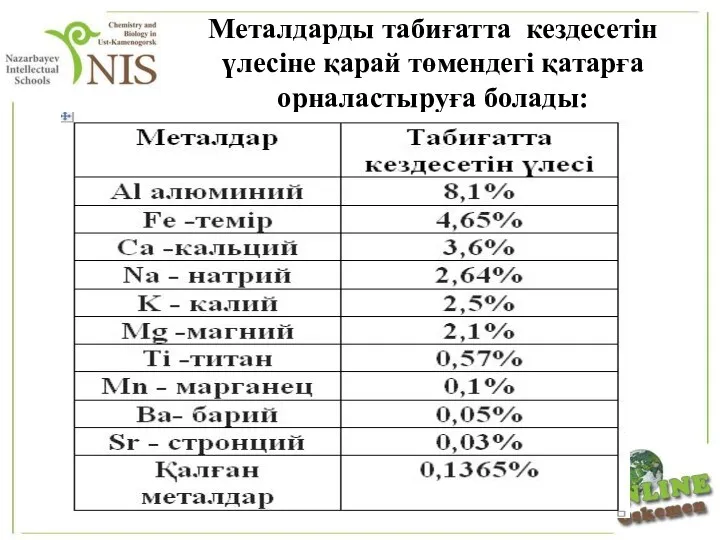
- 21. Металдарды табиғатта кездесетін үлесіне қарай төмендегі қатарға орналастыруға болады:
- 22. Металдардың құрылысы және физикалық қасиеттері Металдар – металдық кристал торын түзеді. Бұл кезде химиялық байланыстың ерекше
- 23. Атомнан босаған электрондар кристалдың барлық құрылымдық бөлшектерінде ортақ қолдануға өтеді де, кристалдың ішінде жеңіл қозғалады және
- 24. Металдық байланыс электрондардағы ортақтасуынан тұратындықтан коваленттік байланысқа ұқсас. Бірақ металдық байланыс жағдайында бұл электрондар металдық кристалдың
- 25. Теріс зарядталған ортақ электрондардың жиынтығы оң зарядталған металдардың иондарын (катиондар) тордың белгілі түйіндерінде оның атомдарымен бірге
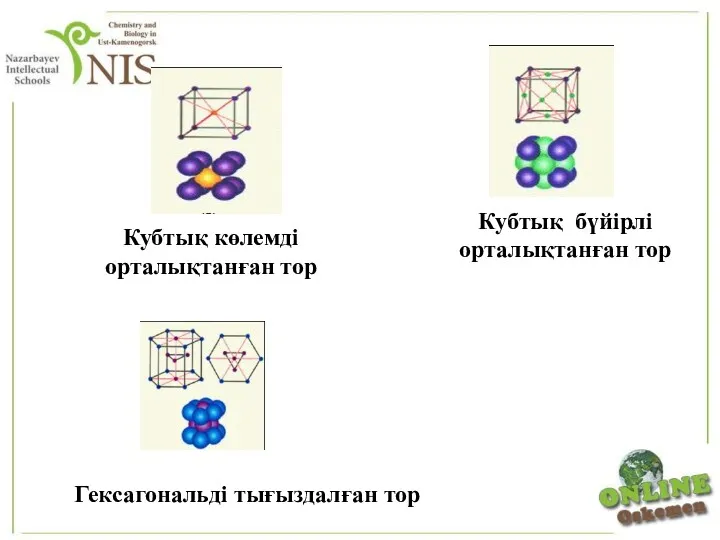
- 26. Гексагональді тығыздалған тор Кубтық бүйірлі орталықтанған тор Кубтық көлемді орталықтанған тор
- 27. Металдың кристалында құрылымдық бөлшектер – иондар мен атомдардың өзара орналасуы шар тәрізді, оларды кеңістіктік тығыздалу деп
- 28. Металдардың физикалық қасиеттері 1. Агрегаттық күйі - қатты. (Ерекшелік! Нg, сынап - сұйық). 2. Түсі сұр.
- 29. І. Тығыздығы бойынша металдар: 1. Жеңіл металдар, ρ 2. Ауыр металдар, ρ>5г/см 3, ең ауыр металл
- 30. ІІ. Балқу температурасына қарай: 1.Оңай балқитын металдар, tб 2. Қиын балқитын металдар, tб>1000 0С; ең қиын
- 31. ІІІ. Қаттылығына байланысты: 1. Қаттылығы алмаздың қаттылығынан (10) төмен металдар жұмсақ металдар д.а., ең жұмсақ металдар
- 32. IV.Өндірістік жіктелуі: 1. Қара металдар-темір және оның құймалары: шойын, болат, ферроқорытпалар, шартты түрде бұл топқа марганец
- 33. Видео №1 Металдардың физикалық қасиеттері, құрлысындағы ерекшеліктерін келесі видео арқылы қорытындылаймыз
- 34. Металдардың химиялық қасиеттері Металдардың атом радиусының үлкен және иондану энергиясы кіші болуына байланысты олар электрондарын оңай
- 35. Металдардың электрондарын беру қабілеті әртүрлі болады, осыған байланысты металдардың активті қатары құрылған, оны ұсынған Н.Н.Бекетов (1865ж).
- 36. 1) Бұл қатарда металдар белсенділігінің кемуі бойынша орналасқан, олай болса тотықсыздандырғыштық қасиеттері Li-ден Au-ға қарай кемиді.
- 37. Қатардың басында тұрған металдар (Li – Al) судан қ.ж сутегін ығыстырып, гидроксид түзеді . Al-ден кейінгі
- 38. Тәжірибе- Металдардың тұздармен әрекеттесуі
- 39. Металдардың қосылыстарының қасиеттері: І.Оксидтері: Сілтілік және сілтілік–жер металдардың оксидтері сумен әрекеттесіп негіздер түзеді, ал қалған металдардың
- 40. Активтік қатарда сутегіне дейін орналасқан металдардың оксидтері қыздыруға төзімді келеді, активтілігі төмен металдардың оксидтері қыздырғанда айырылады.
- 41. ІІ. Гидроксидтері. 1) Металл гидроксидтері - негіздер. Олардың суда еритіндерін сілтілер деп атайды. Сілтілерге І А
- 42. 2) Қыздыруға қатынасы: Сілтілер қыздырғанда айырылмайды, ал ерімейтін негіздер қыздырғанда айырылады: Cu(ОН)2 (t°)→ CuО + Н2О
- 43. ІІІ. Тұздарының қасиеттері: а) Суға қатынасы: Активті металдардың күшті қышқылдармен түзген тұздары гидролизге ұшырамайды (NaCl, Na2SO4,
- 44. Активтілігі төмен металдардың тұздары гидролизге түседі, күшті қышқылдармен түзген тұздарының ортасы қышқылдық, ал әлсіз қышқылдармен түзген
- 45. Металдардың жемірілуі Қоршаған орта факторларының әсерінен металдардың бүліну құбылысы жемірілу (коррозия) (лат. сorrosio- желіну) деп аталады.
- 46. Металдан жасалған өнеркәсіптік ғимараттар, автокөлік бөлшектері, ауылшаруашылық техникасы, энергетика және химия өнеркәсбінің аппараттары жемірілуге ұшырайды.
- 47. Жемірілу нәтижесінде металл массасының азаюына байланысты тура және металдың маңызды қасиеттерінің жойылуына байланысты жанама шығын болады.
- 48. Біз көзбен тек жемірілу процесінің сыртқы көрінісін- таттың түзілуі көреміз. Жемірілу сонымен бірге металды қатты қыздырғанда
- 49. Барлық металдар жемірілуге бірдей ұшырамайды. Кернеу қатарында күмістен кейін тұрған бекзат металдар деп аталатын металдар мүлдем
- 50. Металдардың қоршаған ортаға байланысты жемірілуі химиялық және электрохимиялық деп екіге бөлінеді. Химиялық жемірілу электр тогын өткізбейтін
- 51. Электрохимиялық жемірілу жиірек кездеседі. Электрохимиялық жемірілу жүруінің басты себебі- электролит ерітінділерінің болуы. Жемірілудің бұл түріне атмосферада
- 52. Жемірілумен күресу жолдары 1. Металдарды қорғаныштық беттік қаптамалармен қаптау. 2. Жемірілуге қарсы қасиеттері бар құймалар әзірлеу.
- 53. Металдардың қолданылуы Қазіргі кезде адам өмірінде металдың рөлі ерекше. Металдар техникада маңызды конструкциялық материалдар болып табылады.
- 54. Металдар – бұл құрылыс конструкциясы, химиялық реакторлар, құбырлар, мұнай мұнарасы және т.б. Қазіргі техникада қырықтан астам
- 55. Бірақ адам үшін қандай да бір пайдалы қасиеті болса да металдарда бүгін ғалымдар мен конструкторларға қажет
- 56. Металл құймалары. Құймалар – қатты ерітінділер, олар металдарды немесе металл мен басқа элементтерді бірге балқытқанда түзіледі.
- 57. Жиі қолданылатын құймалар: 1. Шойын – Fe, (ω(С)>1,7 % Мn, Sі, Р, S) машиналардың қозғалмайтын бөлімдерін
- 58. Қоланың түрлері: І. Қалайылы қола, (10 % Sn) ІІ. Алюминийлі қола, (11 % Al) ІІІ. Қорғасынды
- 59. Металдардың алынуы. Құрамында металл қосылыстары бар минералдар мен тау жыныстарынан металды өнеркәсіптік жолмен бөліп алу экономикалық
- 60. Қазақстандағы металл кендері және металл өндірісі аймақтарда төмендегідей болып шоғырланған. Pb, Zn - Текелі, Малеевск, Ащысай;
- 61. Металлургия – ғылымның, техниканың, өнеркәсіптің кеннен немесе басқа да материалдардан металл алу процестерін, сондай-ақ металл қорытпаларға
- 62. Металдарды алу Металлургия өндірісі үш топқа бөлінеді: -пирометаллургия, -гидрометаллургия, -электрометаллургия. Бұл өндірістерде сәйкес жылу, су және
- 63. Пирометаллургиялық әдіс: 1. Металдарды оксидтерінен жоғары температурада, тотықсыздандырғыштарды (С, СО, H2, АІ, Мg, Ca т.б.) қолданып
- 64. Гидрометаллургия — химиялық реагенттердің немесе түрлі еріткіштер көмегімен суда ерітіп кеннен,концентраттардан және әр түрлі өндіріс қалдықтарынан
- 65. Электрометаллургия — электролиз арқылы металдарды алу әдісі. Электролиз дегеніміз металл қосылыстарының ерітінділеріне немесе балқымаларына тұрақты электр
- 66. Үйге тапсырма: Бекітуге арналған сұрақтар: 1.Менделеев жасаған химиялық элементтердің периодтық жүйесіндегі металдардың пайыздық мөлшері? 2.Жеңіл балқитын
- 67. Қолданылған әдебиеттер 1. Б.А. Бірімжанов. Жалпы химия, Алматы 2001 2. Интернет желісі. 3. Е.Н Калюкова СВОЙСТВА
- 69. Скачать презентацию































































 Бензол молекуласында байланыстардың түзілу сызбанұсқасы
Бензол молекуласында байланыстардың түзілу сызбанұсқасы Экспериментально исследовательский проект Соль волшебница
Экспериментально исследовательский проект Соль волшебница Химиялық кинетика және химиялық тепе-теңдік
Химиялық кинетика және химиялық тепе-теңдік Тренувальні вправи. Задачі
Тренувальні вправи. Задачі Техника безопасности в кабинете химии
Техника безопасности в кабинете химии Қалдық мөлшерлер
Қалдық мөлшерлер сложные эфиры
сложные эфиры Закон сохранения массы. Химические уравнения
Закон сохранения массы. Химические уравнения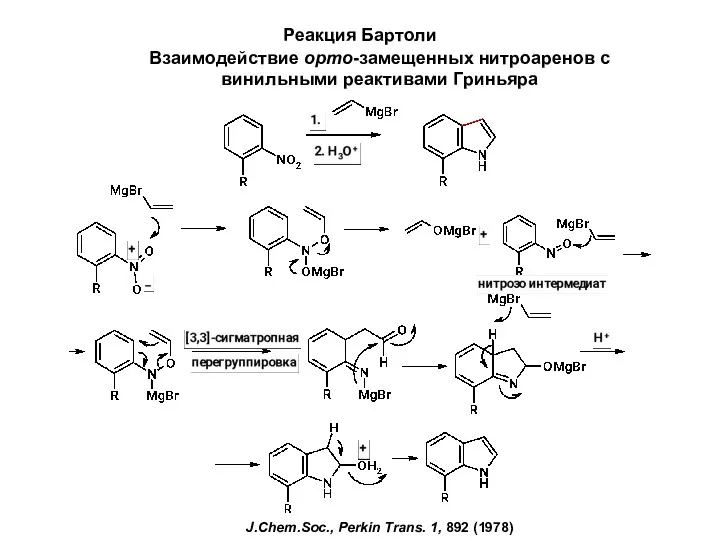 Реакция Бартоли. Взаимодействие орто-замещенных нитроаренов с винильными реактивами Гриньяра
Реакция Бартоли. Взаимодействие орто-замещенных нитроаренов с винильными реактивами Гриньяра Окисно-відновні реакції у природі і промисловості
Окисно-відновні реакції у природі і промисловості Химические свойства толуола
Химические свойства толуола Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Определите положение в ПСХЭ элементов
Определите положение в ПСХЭ элементов Complex compounds
Complex compounds Химия - тұрмыста
Химия - тұрмыста p-элементы 17 группы периодической системы: галогены
p-элементы 17 группы периодической системы: галогены Свойства кислорода. Получение кислорода методом вытеснения воздуха
Свойства кислорода. Получение кислорода методом вытеснения воздуха Самородные элементы
Самородные элементы Товары бытовой химии
Товары бытовой химии Реакції йонного обміну між електролітами у водних розчинах
Реакції йонного обміну між електролітами у водних розчинах Вода – растворитель. Растворы. Значение воды
Вода – растворитель. Растворы. Значение воды Окислительно-восстановительные реакции. (лекция №10)
Окислительно-восстановительные реакции. (лекция №10) Узагальнення й систематизація знань з теми Початкові хімічні поняття (1 частина)
Узагальнення й систематизація знань з теми Початкові хімічні поняття (1 частина) Виды присадок к моторным топливам (керосин)
Виды присадок к моторным топливам (керосин) Сера и ее соединения
Сера и ее соединения Кислород. Химия. 8 класс
Кислород. Химия. 8 класс Последствия применения удобрений в сельском хозяйстве
Последствия применения удобрений в сельском хозяйстве