Содержание
- 2. Мета: -закріпити знання про реакції йонного обміну та умови їх перебігу; -удосконалити вміння записувати рівняння реакцій
- 3. Реакції йонного обміну відбуваються до кінця в трьох випадках: якщо утворюється осад якщо виділяється газ якщо
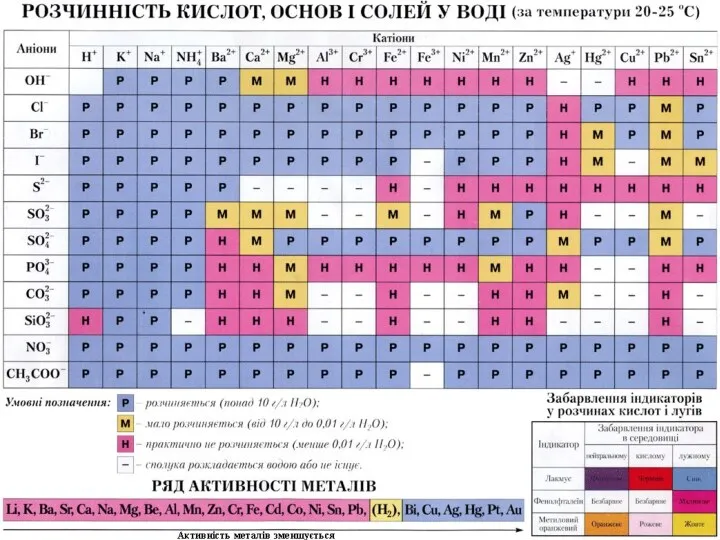
- 4. Обладнання: періодична система хімічних елементів Д.І.Мендєлєєва; таблиця розчинності солей, кислот і основ; пробірки, штатив; реактиви: розчини
- 5. Завдання 1. Нагадаємо правила техніки безпеки при роботі з реактивами
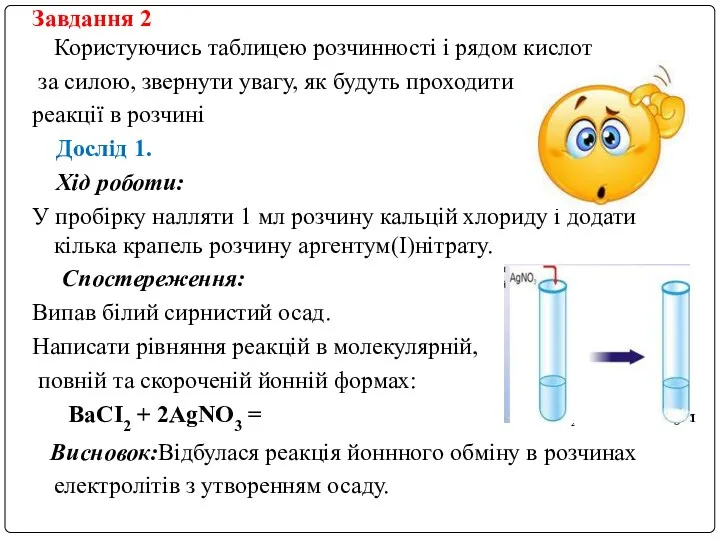
- 7. Завдання 2 Користуючись таблицею розчинності і рядом кислот за силою, звернути увагу, як будуть проходити реакції
- 8. Дослід 2. Хід роботи: У пробірку налляти 1 мл розчину купрум (ІІ) сульфату і додати 1
- 9. Дослід 2. Хід роботи: У пробірку налляти 1 мл розчину натрій карбонату і 1 мл розчину
- 10. Завдання 3. Реакції нейтралізації Дослід1. Хід роботи: У пробірку налляти 1 мл розчину калій гідроксиду, додати
- 11. Дослід 2. Користуючись таблицею розчинності, добрати електроліти за поданим скороченим йонним рівнянням: H+ + OH- →
- 13. 1.Ознайомитись із відеоспостереженнями, які додаються 2. Виконати практичну роботу в зошитах і вислати на перевірку Домашнє
- 15. Скачать презентацию










 Процессы природного минералообразования. Формы природных выделений минералов
Процессы природного минералообразования. Формы природных выделений минералов 20191107_binarnye_oksidy_1
20191107_binarnye_oksidy_1 Основания
Основания Характер химического элемента по кислотно- основным свойствам. (Амфотерные соединения)
Характер химического элемента по кислотно- основным свойствам. (Амфотерные соединения) Химические свойства спиртов. Химические свойства предельных одноатомных спиртов
Химические свойства спиртов. Химические свойства предельных одноатомных спиртов Жаңа дәрілерді жасау
Жаңа дәрілерді жасау Реакции ионного обмена в растворах электролитов. рH раствора как показатель кислотности среды
Реакции ионного обмена в растворах электролитов. рH раствора как показатель кислотности среды Формулы веществ. Относительная атомная масса. Относительная молекулярная масса. Массовая доля элементов в сложных веществах
Формулы веществ. Относительная атомная масса. Относительная молекулярная масса. Массовая доля элементов в сложных веществах Спирты одноатомные и многоатомные
Спирты одноатомные и многоатомные Углерод
Углерод 20230306_oksidy
20230306_oksidy Химические свойства металлов. Электрохимический ряд напряжения металлов
Химические свойства металлов. Электрохимический ряд напряжения металлов Индикаторы на кухне
Индикаторы на кухне Развитие теории восстановления металлов
Развитие теории восстановления металлов Химическая связь
Химическая связь Экспериментальное решение задач по теме: Классы неорганических соединений
Экспериментальное решение задач по теме: Классы неорганических соединений Алкадиены
Алкадиены Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс)
Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс) Термопластичные полимеры
Термопластичные полимеры Сутектік көрсеткіш ph. Тұздар гидролизі
Сутектік көрсеткіш ph. Тұздар гидролизі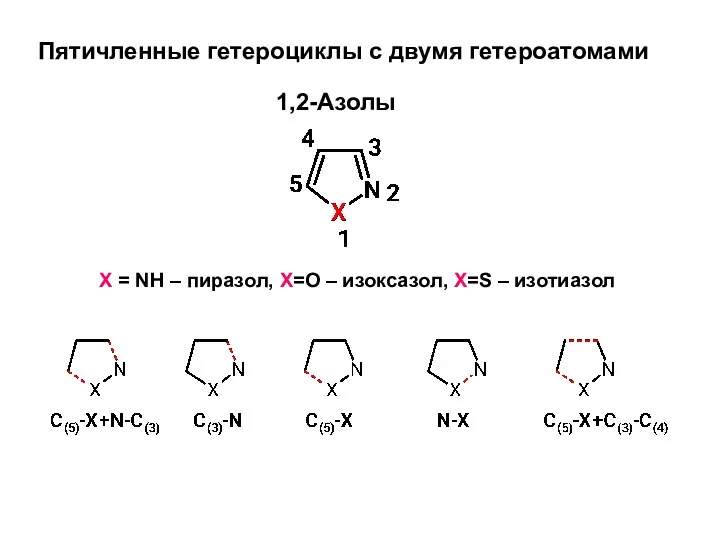 Пятичленные гетероциклы с двумя гетероатомами
Пятичленные гетероциклы с двумя гетероатомами Знакомство с образцами химических средств санитарии и гигиены
Знакомство с образцами химических средств санитарии и гигиены Периодический закон Д. И. Менделеева
Периодический закон Д. И. Менделеева Твердотільний ямр
Твердотільний ямр Оксид меди
Оксид меди Возникновение и развитие научной химии
Возникновение и развитие научной химии Технология получения многослойного и малослойного графена
Технология получения многослойного и малослойного графена Коррозия металлов
Коррозия металлов