Содержание
- 2. Свойства органических веществ определяются их составом и строением. Спирты подтверждают общее правило. Их молекулы включают в
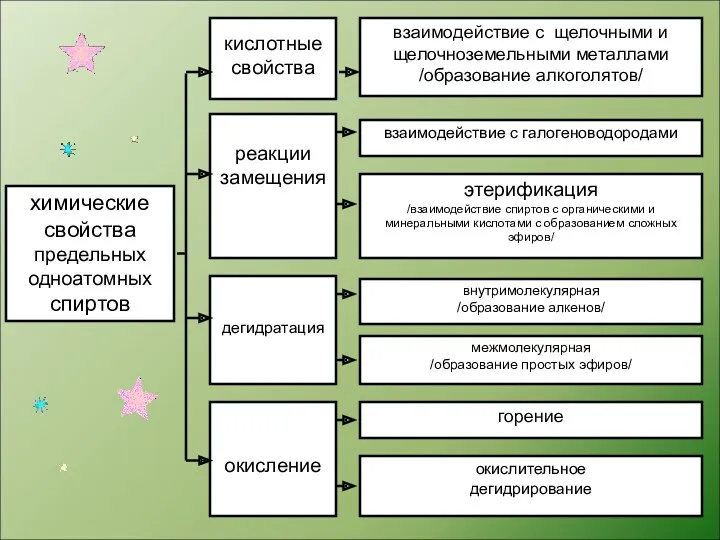
- 3. химические свойства предельных одноатомных спиртов кислотные свойства реакции замещения дегидратация окисление взаимодействие с щелочными и щелочноземельными
- 4. 1. Амфотерные свойства спиртов = а) образование алкоголятов (замещение атома водорода щелочным металлом): этанол (этиловый спирт)
- 5. щелочная среда Этанолят (этилат) натрия гидролизуется: Спирт – настолько слабая кислота, что не вызывает изменение окраски
- 6. б) взаимодействие с галогеноводородными кислотами: этанол (этиловый спирт) хлорэтан (этилхлорид) Для этанола, как и других предельных
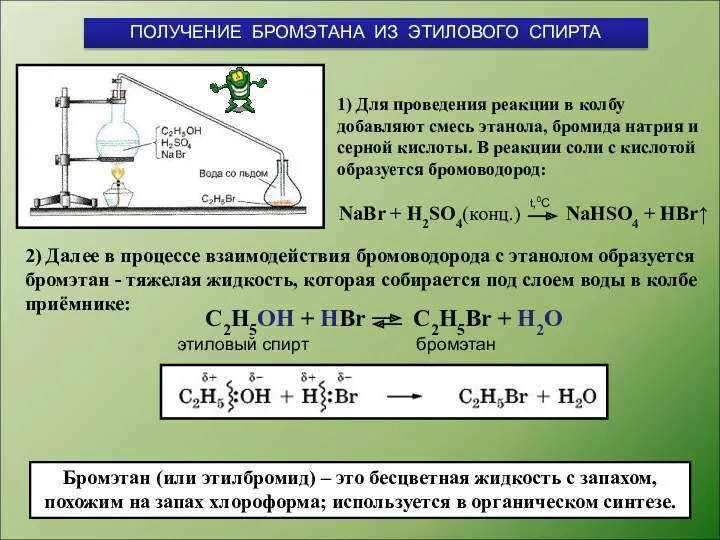
- 7. 1) Для проведения реакции в колбу добавляют смесь этанола, бромида натрия и серной кислоты. В реакции
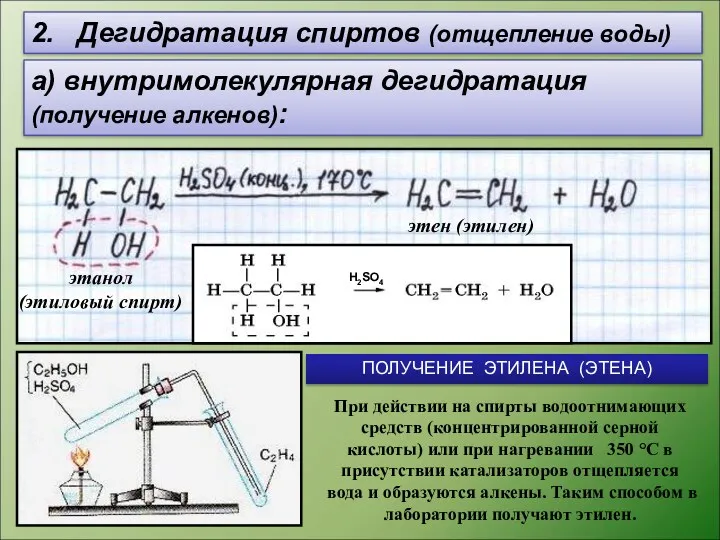
- 8. 2. Дегидратация спиртов (отщепление воды) а) внутримолекулярная дегидратация (получение алкенов): этен (этилен) этанол (этиловый спирт) H2SO4
- 9. б) межмолекулярная дегидратация (получение простых эфиров): этанол (этиловый спирт) диэтиловый эфир Это реакция отщепления атома водорода
- 10. 3. Образование сложных эфиров (взаимодействие с карбоновыми кислотами) – реакция этерификации: этанол (этиловый спирт) этановая (уксусная)
- 11. 4. Реакция дегидрирования (отщепление водорода) - а) первичные спирты превращаются в альдегиды: этанол (этиловый спирт) ацетальдегид
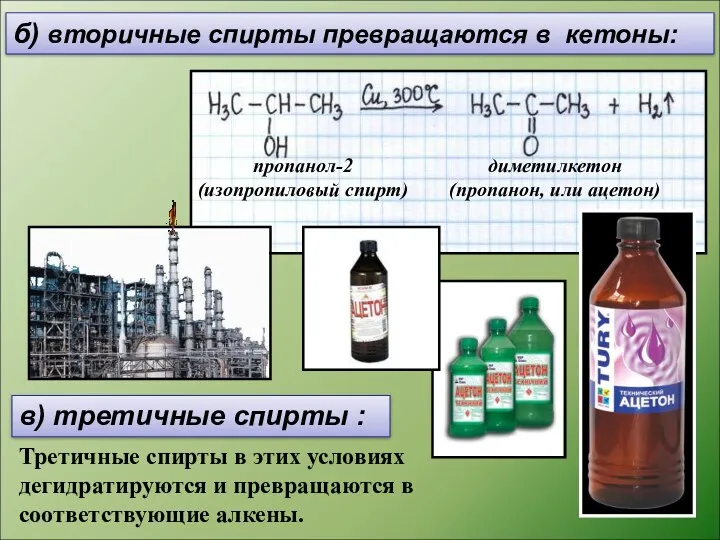
- 12. б) вторичные спирты превращаются в кетоны: в) третичные спирты : Третичные спирты в этих условиях дегидратируются
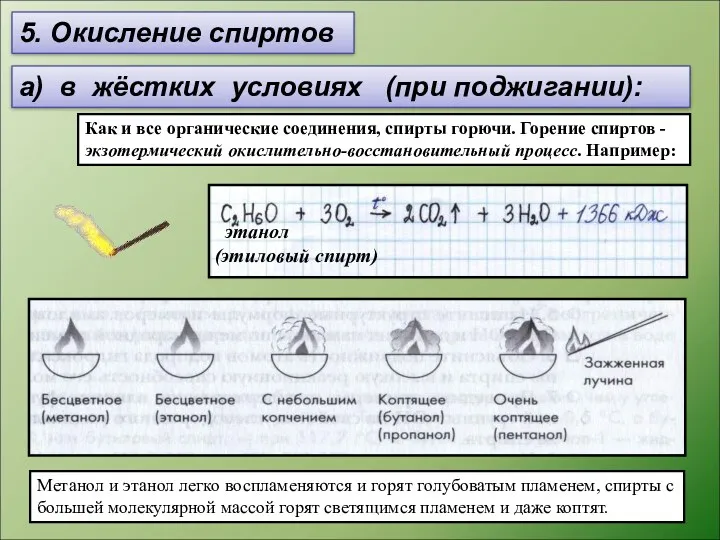
- 13. 5. Окисление спиртов а) в жёстких условиях (при поджигании): Как и все органические соединения, спирты горючи.
- 14. б) в мягких условиях (под действием раствора KMnO4 ): Уравнения реакций окисления этанола и этаналя: 3С2Н5ОН
- 15. в) каталитическое окисление этанола (в присутствии оксида хрома (III) Cr2O3 ): Окисление этилового спирта кислородом воздуха
- 16. г) окислительное дегидрирование спиртов: Это качественная реакция на спирты: цвет осадка изменяется с черного на розовый,
- 17. Тест на алкогольное опьянение Реакцию окисления спиртов сильными окислителями используют для установления факта алкогольного опьянения: K2Cr2O7
- 19. Скачать презентацию











 Иондық байланыс
Иондық байланыс Щелочные металлы
Щелочные металлы Камень чароит
Камень чароит Основные особенности композитов по сравнению с традиционными материалами
Основные особенности композитов по сравнению с традиционными материалами Гидроксид железа
Гидроксид железа Методические проблемы преподавания органической химии и ее основные теоретические понятия
Методические проблемы преподавания органической химии и ее основные теоретические понятия Предмет, история и задачи геохимии, положение среди других наук
Предмет, история и задачи геохимии, положение среди других наук Общая характеристика неметаллов
Общая характеристика неметаллов Классификация и номенклатура органических соединений
Классификация и номенклатура органических соединений Фенол қосылыстары
Фенол қосылыстары Алкадиены. Гомологический ряд, номенклатура и изомерия
Алкадиены. Гомологический ряд, номенклатура и изомерия Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ
Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ Реакции ионного обмена между растворами электролитов
Реакции ионного обмена между растворами электролитов Классификация химических реакций
Классификация химических реакций Этот многоликий цинк
Этот многоликий цинк Аллотропия
Аллотропия Химические свойства толуола
Химические свойства толуола Обмоточные провода
Обмоточные провода Периодические системы химических элементов
Периодические системы химических элементов Барий. Щелочноземельные металлы
Барий. Щелочноземельные металлы Ароматические кислоты фенолокислоты
Ароматические кислоты фенолокислоты Изучение раздела Углеводороды в курсе органической химии в старшей школе
Изучение раздела Углеводороды в курсе органической химии в старшей школе Синтез олиголактозаминов – лигандов галектинов
Синтез олиголактозаминов – лигандов галектинов Білки (протеїни)
Білки (протеїни) Химиялық реакция белгілерін атаңыз
Химиялық реакция белгілерін атаңыз Электрофоретические и хроматографические методы
Электрофоретические и хроматографические методы Основания. 8 класс
Основания. 8 класс Производство серной кислоты контактным способом
Производство серной кислоты контактным способом