Содержание
- 2. Масштабы агрегации вещества в результате фундаментальных взаимодействий Ньютоновская механика Квантовая механика
- 3. N r N – порядковый номер элемента, r – электронный уровень Электромагнитная связь в атомах химических
- 4. Химическая связь в молекулах (и телах)
- 5. Природа металлической связи (модель Н. Бора) Природа металлической связи (квантомеханическая модель)
- 6. Отдельные атомы металлом не являются – это типичный газ Атомы становятся металлом в результате конденсации и
- 7. Кларк элементов Окислителями металлов являются F, Cl, Br, O, S и др.
- 8. Структура оксидов Упаковка анионов Окто- и тетрапоры
- 9. Ионная и ковалентная связь Ионная и ковалентная связь Ионная и ковалентная связь
- 10. Доменное производство – результат развития ремесла получения металлов Процесс ориентирован на переработку моноруд
- 11. В основе современных восстановительных технологий лежат химические процессы удаления из руды кислорода MeO + C =
- 12. В основе современных восстановительных теорий лежат: Принцип А.А. Байкова – принцип последовательного превращения высших оксидов в
- 13. Кристаллическая решётка шпинели (Mg2m+, Fe2n+)[Fe3x+,Al3y+,Cr3z+]O4: плотнейшая упаковка анионов и множество катионных вакансий а – плотнейшая упаковка
- 14. «Механизм химических процессов может быть понят лишь на основе физических теорий, описывающих движение реагирующих молекул и
- 15. Окисление и восстановление – это потеря электронов атомом металла с превращением его в катион и возвращение
- 16. В основе наших теоретических построений ежат два очевидных, но ещё недооцененных принципиальных положения: 1. При твёрдофазном
- 17. MeO + CО = Me + CO2; MeO + C = Me + CO Однако в
- 18. В анионной вакансии «лишние» электроны окружены одинаковыми катионами. Поэтому они легко переходят от одного катиона к
- 19. ΔGΣ = ΔGV +ΔGF, ΔGΣ = ΔgV·4/3πr3 + σ·4πr2 rкрит = 2σ / ·ΔgV ; σ
- 20. Превращение оксида в металл происходит минуя этап образования атомов. Для металлического зародыша при восстановлении не существует
- 21. Эффект буксировки – селективное восстановление Если все катионы одинаковы, то электроны сопровождают вакансию, переходя от одного
- 22. Состав металлической фазы на начальной стадии восстановления из марганцевой руды Содержание элементов, ат.%
- 23. Образование металлической оболочки на оксиде Возгонка низших оксидов - бертолидов образование фаз Магнели, образование карбидов на
- 24. Заряд катиона в оксидах– функция парциального давления кислорода μm = μm° +μRT lnam + μγm μ{O}
- 25. Al2O3-x Al3O4 AlO Al2O Низшие оксиды - продукты восстановления алюминия Низшие оксиды - продукты восстановления алюминия
- 26. Перенос оксидов хрома через газовую фазу и образование карбидов на поверхности восстановителя
- 27. O Mg Al Si Ca Ti Cr Fe 1 61.1 5.4 4.3 0.3 0.0 0.2 16.4
- 28. Cr Fe 1 50.0 50.0 2 22.0 78.0 3 30.3 69.7 атомные % Состав металла в
- 29. Восстановление железа происходит не только в кристаллах шпинели, но и в «пустой» породе Размер частиц железа
- 30. Металло-магнезиальный композит в куске сидеритовой руды
- 31. При медленном восстановлении формируются идиоморфные кристаллы
- 32. Спектр O Na Mg Al Si K Ca Ti V Mn Fe Ni Спектр 1 0
- 33. Принципиальные положения 1. Суть восстановления металлов заключается в объединении катионов кристаллической решётки оксидов металлической связью путём
- 34. 4. В случае относительно медленного восстановления металлов, например из оксидов, в которых кислород связан с разными,
- 35. 7. Проникновение восстановительного процесса в объём оксида обусловлено не диффузией атомов или ионов, а движением вакансий
- 36. Каждая теория, прежде чем быть принятой, проходит четыре стадии: это бесполезная чепуха; это интересно, но неправильно;
- 38. Скачать презентацию
 Алканы. Состав, строение, свойства и химические превращения. Экологические последствия. Синтезы генетическая связь
Алканы. Состав, строение, свойства и химические превращения. Экологические последствия. Синтезы генетическая связь Бензол
Бензол Аммиак. Физические и химические свойства аммиака
Аммиак. Физические и химические свойства аммиака Основные классы неорганических соединений
Основные классы неорганических соединений Эквивалент. Лекция 1
Эквивалент. Лекция 1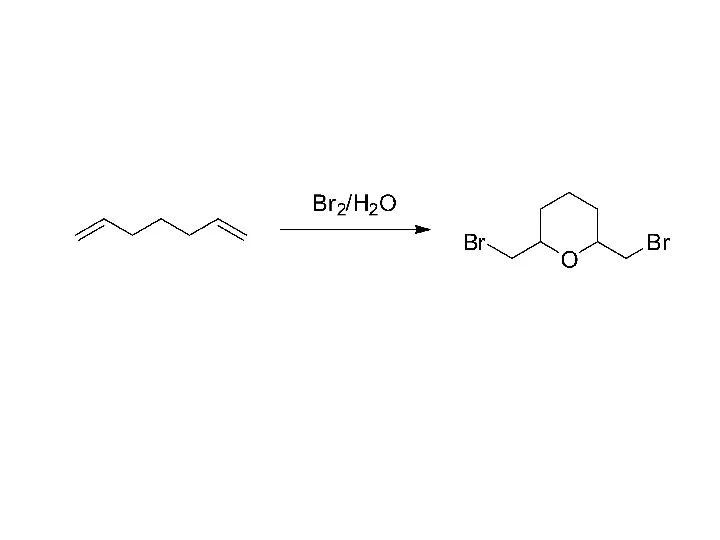 Превращение (S)-бутанол-2 в другие соединения
Превращение (S)-бутанол-2 в другие соединения Нитрид галлия. Основные свойства и применение. GaN и твердые растворы на его основе
Нитрид галлия. Основные свойства и применение. GaN и твердые растворы на его основе Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты
Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты Периодический закон Д.И. Менделеева. Периодическая система химических элементов
Периодический закон Д.И. Менделеева. Периодическая система химических элементов Алкины. Ацетилен (Этин) – С2Н2
Алкины. Ацетилен (Этин) – С2Н2 Реакции ионного обмена
Реакции ионного обмена Ароматические углеводороды. 10 класс
Ароматические углеводороды. 10 класс Строение атома и периодический закон
Строение атома и периодический закон Минерал лазурит. Месторождения
Минерал лазурит. Месторождения Твердое состояни вещества
Твердое состояни вещества Этанол. Одноатомный спирт
Этанол. Одноатомный спирт Бинарные соединения: оксиды, гидриды
Бинарные соединения: оксиды, гидриды Растворы. Типы растворов
Растворы. Типы растворов Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Електроліти в сучасних акумуляторах
Електроліти в сучасних акумуляторах Биохимические аспекты биотрансформации лекарственных веществ
Биохимические аспекты биотрансформации лекарственных веществ 20230419_kolichestvo_veshchestva_mol
20230419_kolichestvo_veshchestva_mol Гірські породи
Гірські породи Галогены. Астат
Галогены. Астат Теория растворов (лекция 2)
Теория растворов (лекция 2) Диены (диолефины, алкадиены)
Диены (диолефины, алкадиены) Альдегиды и кетоны
Альдегиды и кетоны Сулы ерітінділер. Тірі ағза сұйықтықтарындағы тепе-теңдік
Сулы ерітінділер. Тірі ағза сұйықтықтарындағы тепе-теңдік