Содержание
- 2. К концу урока ты будешь способен: 1. Различать необратимые и обратимые реакции; 2. Составлять уравнения электролитической
- 3. Дайте определение с точки зрения ТЭД: Что такое кислоты? Кислоты – это электролиты, которые диссоциируют с
- 4. Дайте определение с точки зрения ТЭД: Что такое основания? Щёлочи (ратворимые в воде основания) – это
- 5. Дайте определение с точки зрения ТЭД: Что такое соли? Соли – это электролиты, которые диссоциируют с
- 6. К электролитам относится: 1) BaO 2) СaСO3 3) K3PO4 4) Al(OH)3
- 7. К электролитам не относится: 1) BaCl2 2) ZnSO4 3) H2SO4 4) CO2
- 8. Сильный электролит – это: 1) H2SO3 H2SiO3 H2SO4 H2S
- 9. Вещество, при диссоциации которого образуются силикат-ионы, – это: 1) K2SiO3 2) SiO2 3) H2SiO3 4) CaSiO3
- 10. Вещество, при диссоциации которого образуются катионы цинка, – это: 1) ZnSO3 2) ZnO 3) Zn(OH)2 4)
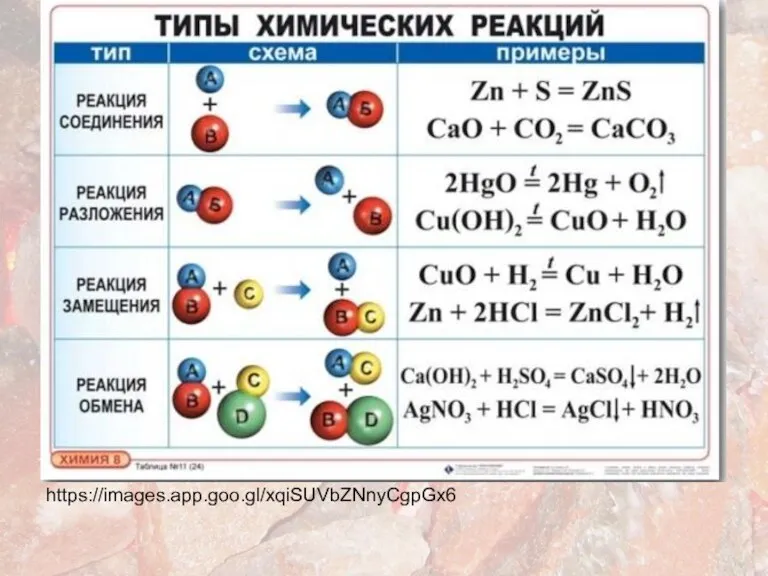
- 11. https://images.app.goo.gl/xqiSUVbZNnyCgpGx6
- 12. При протекании реакции обмена в растворе, взаимодействие происходит между ионами, а не молекулами, т.к. электролиты способны
- 13. Соль и щёлочь могут взаимодействовать (см. учебник 8 класса на стр.85,87) Составим уравнение этой реакции Al(NO3)3
- 15. Al(NO3)3 + 3NaOH = Al(OH)3+ 3NaNO3 Р Р Р Н Каждое растворимое вещество представим в диссоциированной
- 16. Можно заметить, что в левой и правой частях уравнения есть одинаковое число одинаковых ионов. Это ионы
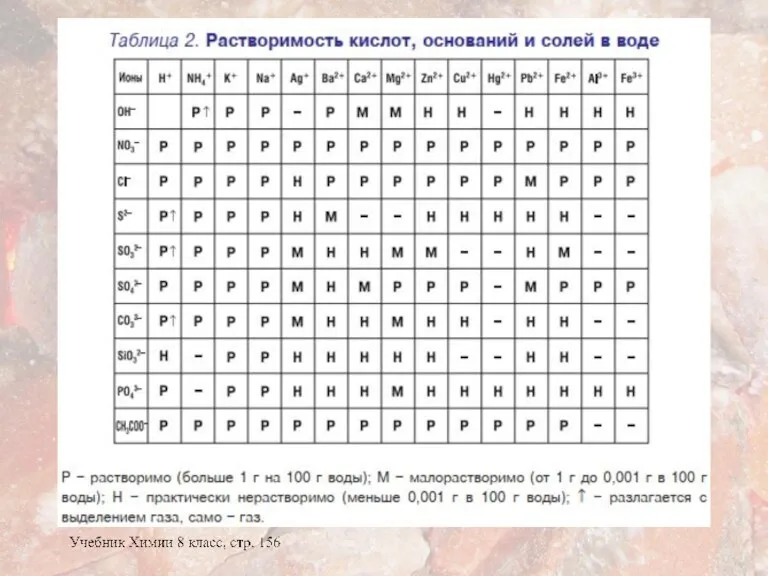
- 17. При составлении ионных уравнений следует проверить две вещи: Растворимо или нет каждое вещество? Сильный или слабый
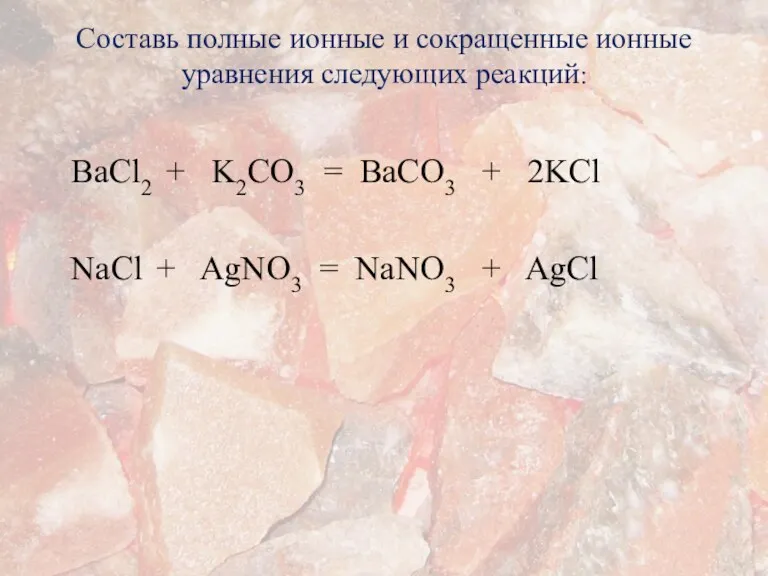
- 18. Cоставь полные ионные и сокращенные ионные уравнения следующих реакций: BaCl2 + K2СO3 = BaСO3 + 2KCl
- 19. Проверь себя: BaCl2 + K2СO3 = BaСO3 + 2 KCl Ba2+ + 2Cl - + 2K+
- 20. NaCl + AgNO3 = NaNO3 + AgCl Проверь себя: Na+ + Сl- + Ag+ + NO3-
- 21. Если тебя заинтересовала данная тема: Изучи §5.11.3, учебник 8 класс Выполни упр. 11, стр. 137. Спасибо
- 23. Скачать презентацию














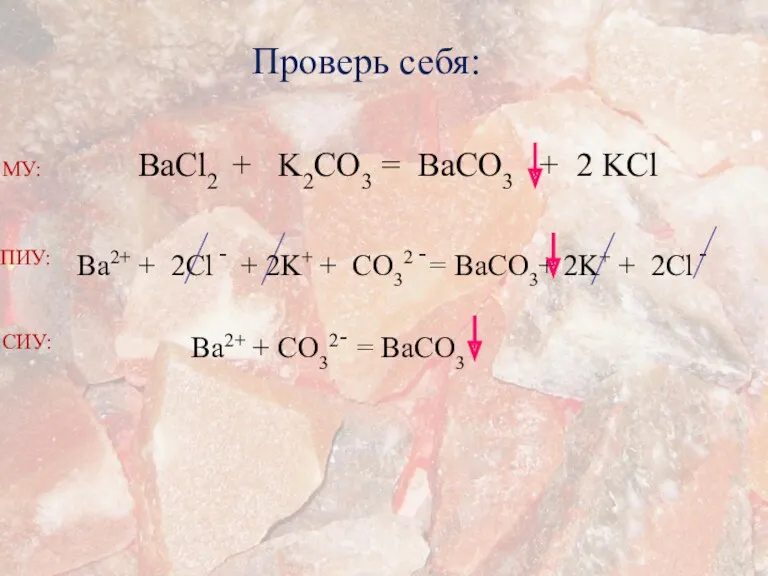


 Металлы – простые вещества
Металлы – простые вещества Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения
Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения Органическая химия
Органическая химия Электрохимические процессы. Лекция 7
Электрохимические процессы. Лекция 7 Коррозия и защита материалов
Коррозия и защита материалов Изучение физико-химических показателей качества макаронных изделий
Изучение физико-химических показателей качества макаронных изделий Хром. Строение атома
Хром. Строение атома Ерiтiндiлер туралы iлiм. Сұйытылған бейэлектролит және электролит ерiтiнндiлерiнiң коллигативтiк қасиеттерi
Ерiтiндiлер туралы iлiм. Сұйытылған бейэлектролит және электролит ерiтiнндiлерiнiң коллигативтiк қасиеттерi Виды деструкции
Виды деструкции Химиялық тепе-теңдік
Химиялық тепе-теңдік Электролитическая диссоциация. Электролиты и неэлектролиты
Электролитическая диссоциация. Электролиты и неэлектролиты Количество вещества. 8 класс
Количество вещества. 8 класс Классификация химических элементов. 8 класс
Классификация химических элементов. 8 класс Зависимость свойств веществ от типа химической связи и кристаллической решетки
Зависимость свойств веществ от типа химической связи и кристаллической решетки Получение галогенов. Биологическое значение и применение галогенов
Получение галогенов. Биологическое значение и применение галогенов Периодический закон и периодическая система Д.И. Менделеева
Периодический закон и периодическая система Д.И. Менделеева Общая и неорганическая химия
Общая и неорганическая химия Амины. Анилин
Амины. Анилин Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ
Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ Поняття про неорганічні та органічні речовини
Поняття про неорганічні та органічні речовини Atomic mass
Atomic mass Окислительновосстановительные реакции (ОВР)
Окислительновосстановительные реакции (ОВР) Зелёная химия
Зелёная химия Химические свойства основных неорганических соединений в свете ЭД и ОВР (9 класс)
Химические свойства основных неорганических соединений в свете ЭД и ОВР (9 класс) Химия и производство
Химия и производство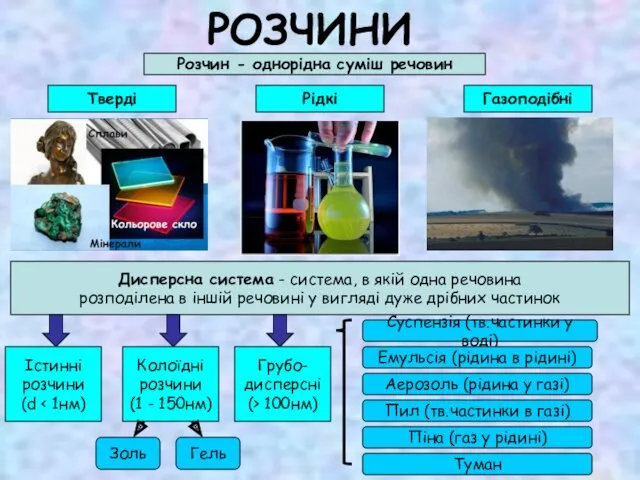 Розчини
Розчини Реакции SR в ряду алканов
Реакции SR в ряду алканов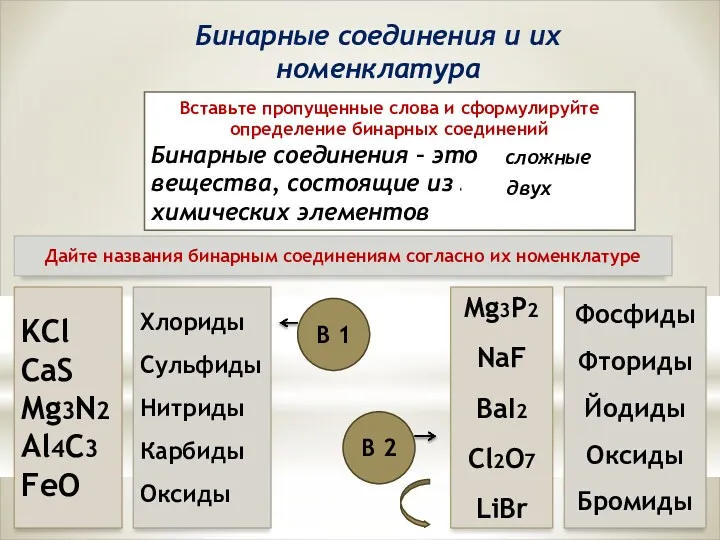 Бинарные соединения и их номенклатура
Бинарные соединения и их номенклатура