Содержание
- 2. Основные понятия химии Современное определение химии система химических наук (органическая, неорганическая, аналитическая, физическая химия и т.д.),
- 3. Основные понятия химии Вещество – вид материи, которая обладает массой покоя. Состоит из элементарных частиц: электронов,
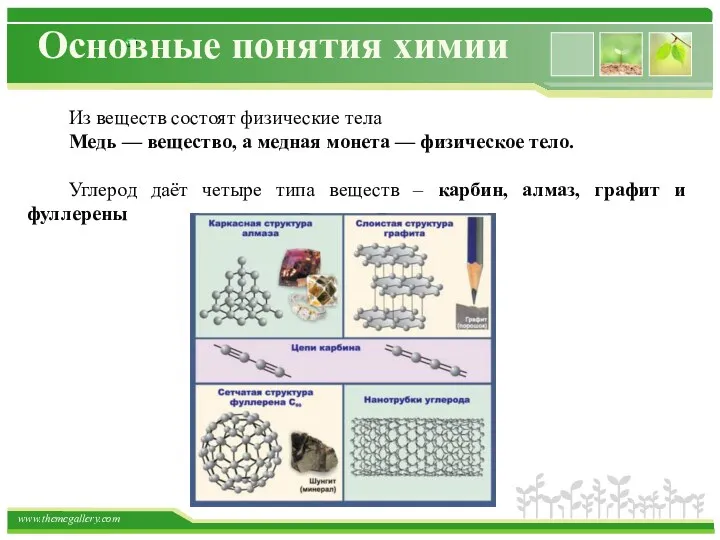
- 4. Основные понятия химии Из веществ состоят физические тела Медь — вещество, а медная монета — физическое
- 5. Основные понятия химии Вещества принято подразделять на простые и сложные Простые вещества образованы атомами одного хим.
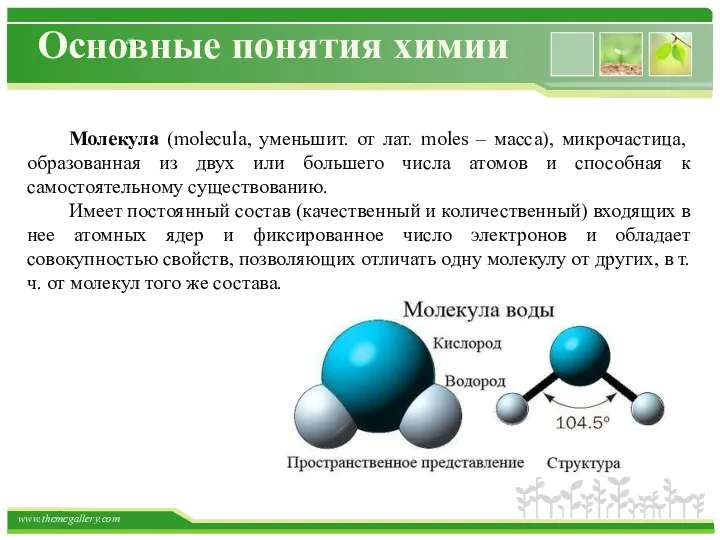
- 6. Основные понятия химии Молекула (molecula, уменьшит. от лат. moles – масса), микрочастица, образованная из двух или
- 7. Основные понятия химии Атом (от греч. atomos – неделимый), наименьшая частица химического элемента, сохраняющая все его
- 8. Основные понятия химии Известно 118 химических элементов из них: - 94 обнаружены в природе (некоторые —
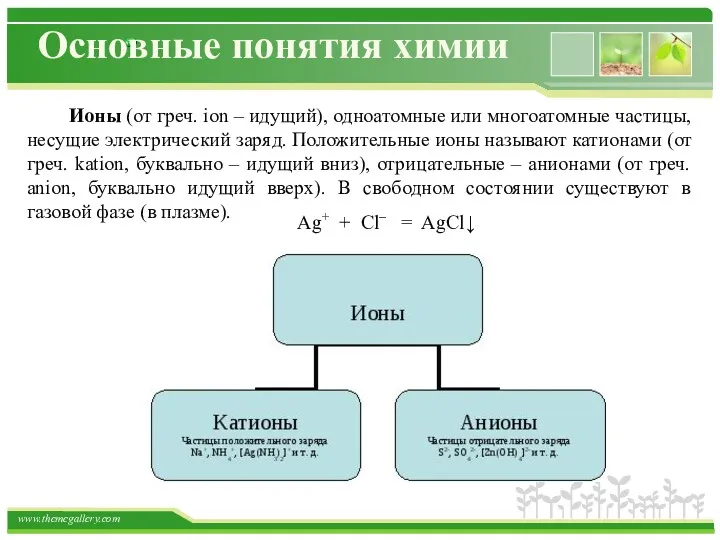
- 9. Основные понятия химии Ионы (от греч. ion – идущий), одноатомные или многоатомные частицы, несущие электрический заряд.
- 10. Основные понятия химии Степень окисления - это условный заряд атомов химического элемента в соединении, вычисленный из
- 11. Строение атома Современные представления о строении атома До конца XIX в. атом считали неделимой частицей, но
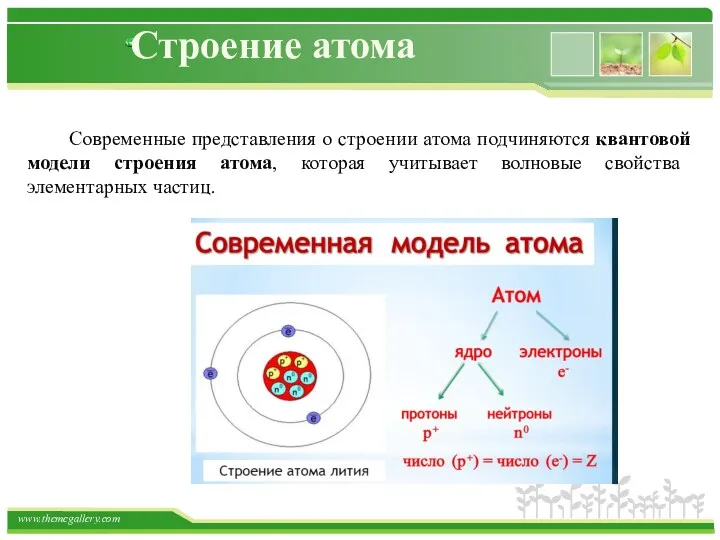
- 12. Строение атома Современные представления о строении атома подчиняются квантовой модели строения атома, которая учитывает волновые свойства
- 13. Строение атома Основные положения квантовой модели строения атома • Электрон имеет двойственную (корпускулярно-волновую) природу, т.е. ведет
- 14. Строение атома Атом - это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
- 15. Строение атома Массы протона и нейтрона примерно одинаковы, их принимают равными 1. Масса электрона намного меньше
- 16. Строение атома Изотопы - химические элементы с одинаковыми зарядами ядер, но различными массовыми числами за счет
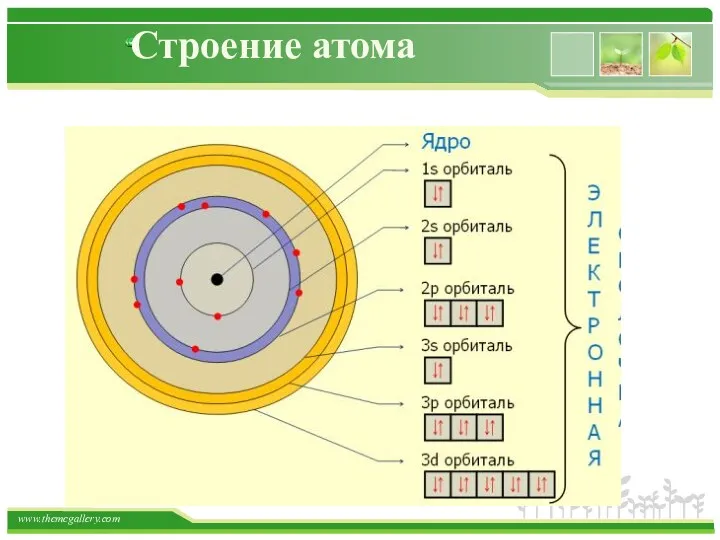
- 17. Строение атома Строение электронной оболочки атома Атом состоит из ядра и электронной оболочки. Электронная оболочка атома
- 18. Строение атома Главное квантовое число n определяет энергетический уровень электрона, удаленность уровня от ядра, размер электронного
- 19. Строение атома Орбитали, имеющие одинаковые значения n, близки между собой по энергии и по размерам, они
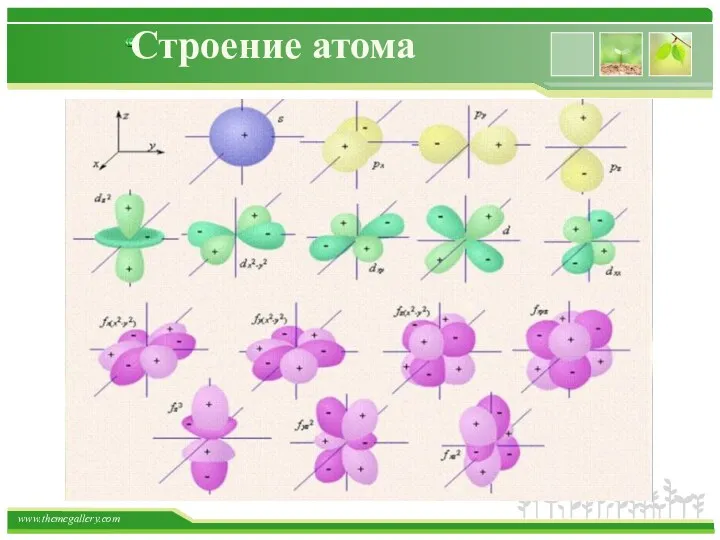
- 20. Строение атома На одном энергетическом уровне могут находиться электронные облака, имеющие различные геометрические формы. Орбитальное квантовое
- 21. Строение атома
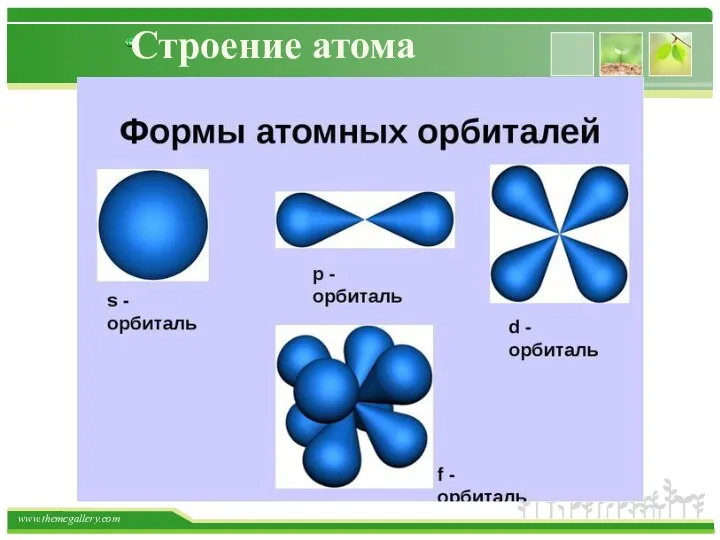
- 22. Строение атома Орбитали, для которых l = 0, имеют форму сферы и называются s-орбиталями. Они содержатся
- 23. Строение атома Энергия орбиталей, находящихся на одном энергетическом уровне, но имеющих разную форму, неодинакова: Es Энергетический
- 24. Строение атома
- 25. Строение атома Магнитное квантовое число ml характеризует ориентацию орбиталей (электронных облаков) в пространстве и принимает значения
- 26. Строение атома
- 27. Строение атома Rаждая орбиталь и электрон, находящийся на этой орбитали, характеризуются тремя квантовыми числами: главным, побочным
- 28. Строение атома Порядок заполнения электронами энергетических уровней Запись распределения электронов в атомах по электронным уровням и
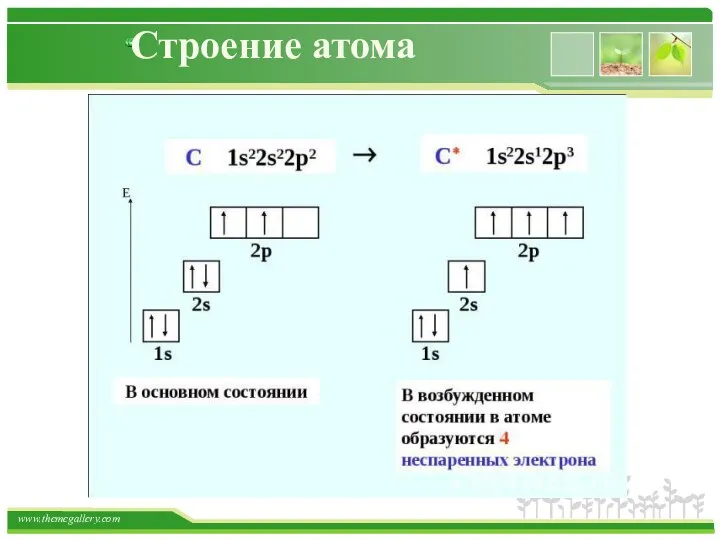
- 29. Строение атома Правило 2. Принцип запрета Паули. В атоме не может быть двух электронов с одинаковым
- 30. Строение атома Правило 3. Правило Хунда. На одном подуровне электроны располагаются так, чтобы абсолютное значение суммы
- 31. Периодическая таблица
- 32. Строение атома
- 33. Строение атома
- 34. Периодическая таблица
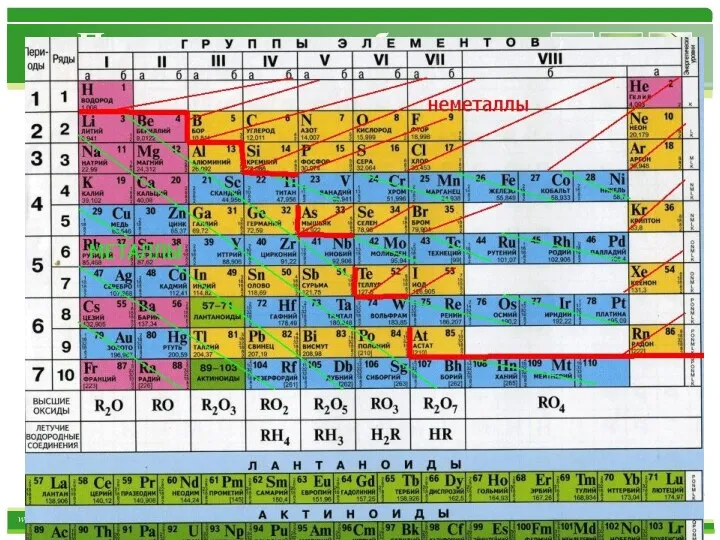
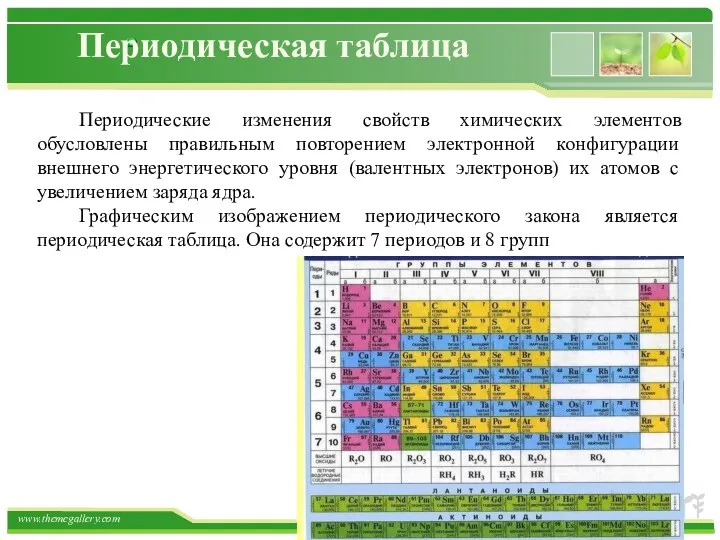
- 35. Периодическая таблица Свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости
- 36. Периодическая таблица В периодической системе любой формы для каждого элемента указывается его символ, порядковый номер (заряд
- 37. Периодическая таблица Периодические изменения свойств химических элементов обусловлены правильным повторением электронной конфигурации внешнего энергетического уровня (валентных
- 38. Периодическая таблица Период - горизонтальные ряды элементов с одинаковым максимальным значением главного квантового числа валентных электронов.
- 39. Периодическая таблица Каждый период содержит определённое число элементов. Периоды могут состоять из 2 (первый), из 8
- 40. Периодическая таблица Группы - вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Номер
- 41. Периодическая таблица Главные подгруппы (А) состоят из элементов малых и больших периодов, валентные электроны которых расположены
- 42. Периодическая таблица В малых периодах от щелочного металла к инертному газу: • заряд ядер атомов увеличивается;
- 43. Периодическая таблица В главных подгруппах сверху вниз: • число энергетических уровней в атоме увеличивается; • число
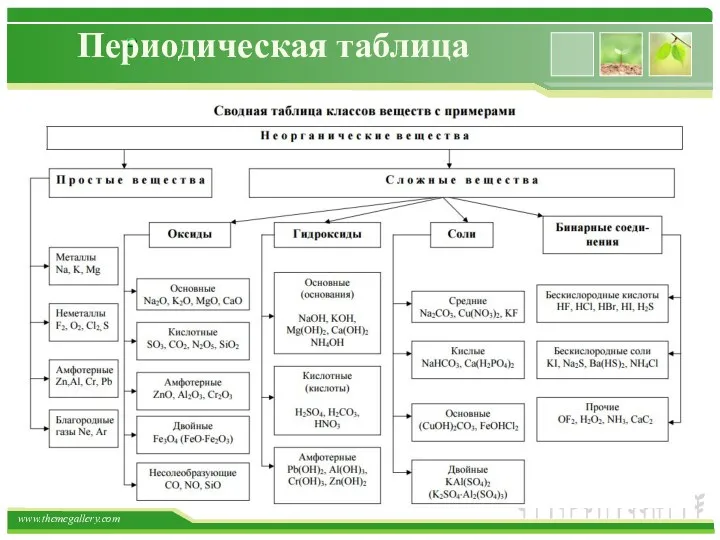
- 44. Периодическая таблица Основные классы неорганических соединений Химический элемент существует в следующих формах: • Одиночные атомы (обычно
- 45. Периодическая таблица ОКСИДЫ Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород.
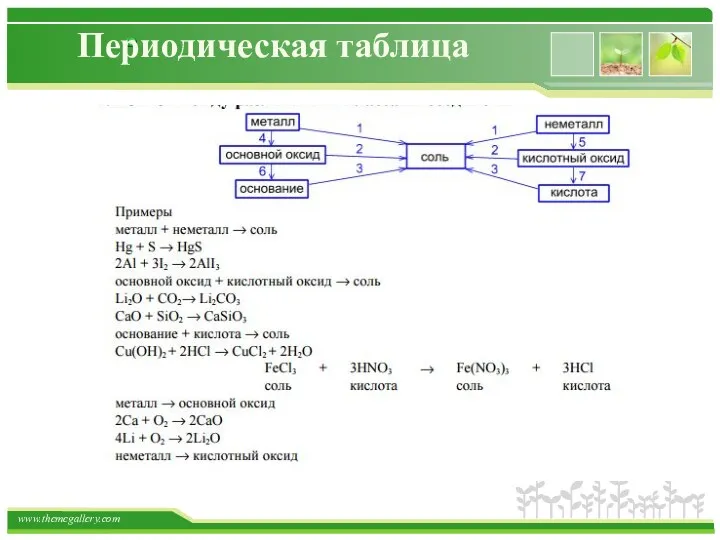
- 46. Периодическая таблица Получение 1. Реакции активных металлов ( щелочных и щелочноземельных металлов) с водой: 2Na +
- 47. Периодическая таблица Химические свойства
- 48. Периодическая таблица ОСНОВАНИЯ Основания - сложные вещества, в которых атомы металлов соединены с одной или несколькими
- 49. Периодическая таблица Получение 1. Реакции активных металлов ( щелочных и щелочноземельных металлов) с водой: 2Na +
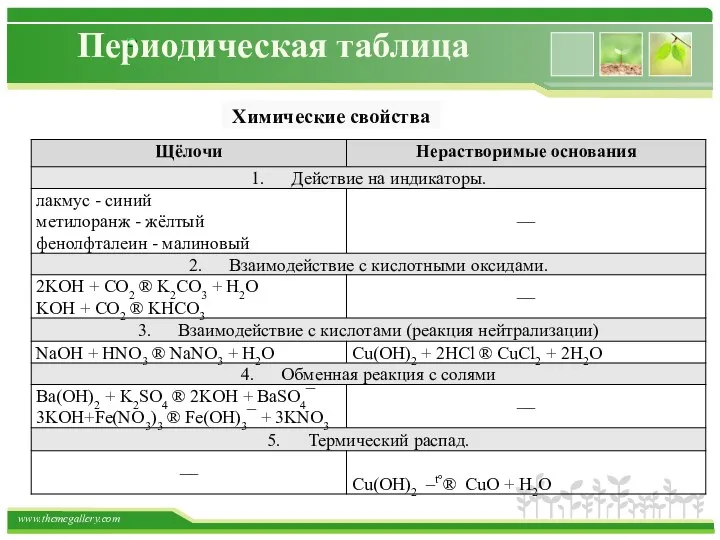
- 50. Периодическая таблица Химические свойства
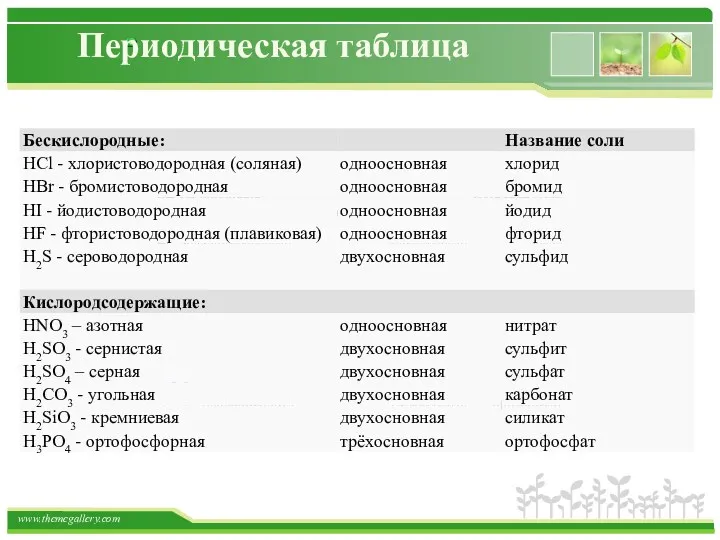
- 51. Периодическая таблица КИСЛОТЫ Кислоты - сложные вещества, состоящие из атомов водорода и кислотного остатка. (С точки
- 52. Периодическая таблица
- 53. Периодическая таблица Получение 1. Взаимодействие кислотного оксида с водой (для кислородсодержащих кислот): SO3 + H2O →
- 54. Периодическая таблица Химические свойства 1. Действие на индикаторы. лакмус - красный метилоранж - розовый 2. Взаимодействие
- 55. Периодическая таблица СОЛИ Соли - сложные вещества, которые состоят из атомов металла и кислотных остатков. Классификация
- 56. Периодическая таблица Средние. При диссоциации дают только катионы металла (или NH4+) Na2SO4 → 2Na+ +SO42- CaCl2
- 57. Периодическая таблица Средние соли Получение Большинство способов получения солей основано на взаимодействии веществ с противоположными свойствами:
- 58. Периодическая таблица Средние соли 5) основного оксида с кислотой CuO + H2SO4 –t°® CuSO4 + H2O
- 59. Периодическая таблица Химические свойства 1. Термическое разложение. CaCO3 ® CaO + CO2 2Cu(NO3)2 ® 2CuO +
- 60. Периодическая таблица Кислые соли Получение 1. Взаимодействие кислоты с недостатком основания. KOH + H2SO4 ® KHSO4
- 61. Периодическая таблица Основные соли Получение 1. Гидролиз солей, образованных слабым основанием и сильной кислотой ZnCl2 +
- 62. Периодическая таблица Комплексные соли Получение 1. Реакции солей с лигандами: AgCl + 2NH3 ® [Ag(NH3)2]Cl FeCl3
- 63. Периодическая таблица
- 64. Периодическая таблица
- 65. Периодическая таблица
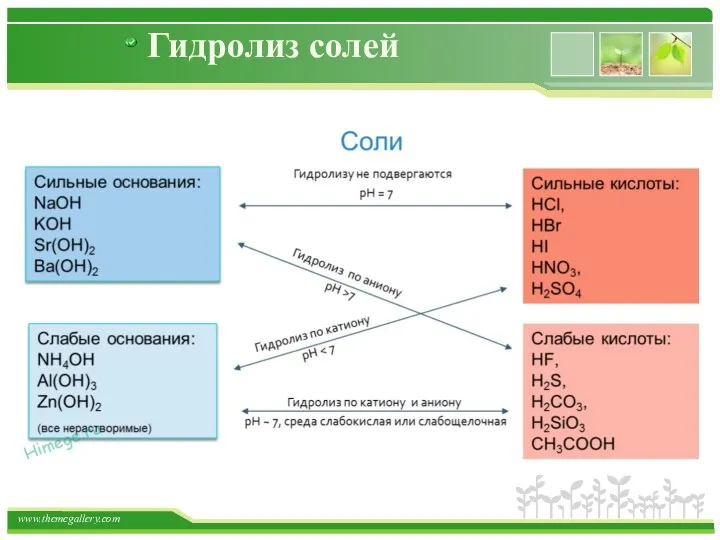
- 66. Гидролиз солей Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию
- 67. Гидролиз солей Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию
- 68. Гидролиз солей Соль, образованная сильным основание и сильной кислотой гидролизу в растворе не подвергаются; не образуется
- 69. Гидролиз солей
- 70. Гидролиз солей Соль, образованная слабым основанием и сильной кислотой протекает всегда по катиону; количество катионов определяет
- 71. Гидролиз солей
- 72. Гидролиз солей Соль, образованная слабым основанием и слабой кислотой Реакция одновременно идет и по катиону и
- 73. Гидролиз солей
- 74. Гидролиз солей
- 76. Скачать презентацию


























































 Горение жидкого топлива
Горение жидкого топлива Соли (12 класс)
Соли (12 класс) Задачи по химии
Задачи по химии Кислоты: классификация и химические свойства
Кислоты: классификация и химические свойства Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Catalysis. Topic 3.2
Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Catalysis. Topic 3.2 Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки
Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки Биоразлагаемые ПАВ. Лекция 2
Биоразлагаемые ПАВ. Лекция 2 Волшебница - вода
Волшебница - вода Аминокислоты. Белки
Аминокислоты. Белки Учение о растворах. Фазовые равновесия
Учение о растворах. Фазовые равновесия Природный газ
Природный газ Дослідження швидкості росту кристалів від концентрації розчину
Дослідження швидкості росту кристалів від концентрації розчину Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка
Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка Общие свойства металлов
Общие свойства металлов Амины. Общая характеристика, номенклатура, изомерия. Получение. Физико-химические свойства. Отдельные представители
Амины. Общая характеристика, номенклатура, изомерия. Получение. Физико-химические свойства. Отдельные представители Классификация химических реакций
Классификация химических реакций Производство извести в домашних условиях. 7 класс
Производство извести в домашних условиях. 7 класс Отчет о прохождении производственно-технологической практики
Отчет о прохождении производственно-технологической практики Химическое равновесие
Химическое равновесие Химия селена и теллурар
Химия селена и теллурар Комплексні сполуки
Комплексні сполуки Теория сплавов
Теория сплавов Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Розв'язування задач за рівнянням хімічних реакцій
Розв'язування задач за рівнянням хімічних реакцій Электролитическая диссоциация
Электролитическая диссоциация Гидролиз солей
Гидролиз солей Химическая связь. Электроотрицательность и полярность связи
Химическая связь. Электроотрицательность и полярность связи Вуглеводи
Вуглеводи