Називають електронегативні ліганди з закінченням на „о”:
Cl-– хлоро, CN-
– ціано, NО3- – нітро , ОН- -гідроксо і т.д.
2. Називають катіон зовнішньої сфери позначаючи їх грецькими числівниками: 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта, 8 – окта
3. Якщо в сполуці присутні ліганди – нейтральні молекули, позначають і їх (NH3 – амін, H2O – акво).
4. Центральному атому додають до латинської назви елемента з закінченням „ат” коли він є комплексним аніоном(якщо елемент має змінну ступінь окислення, її вказують в дужках римськими цифрами перед назвою елемента).
К4[Fe(CN)6] – калій гексаціаноферат(ІІ)
K3[Fe(CN)6] – калій гексаціаноферат (ІІІ)
Na2[Zn(OH)4] – натрій тетрагідроксоцинкат
2. Номенклатура комплексних сполук
Сполуки, що містять комплексний аніон
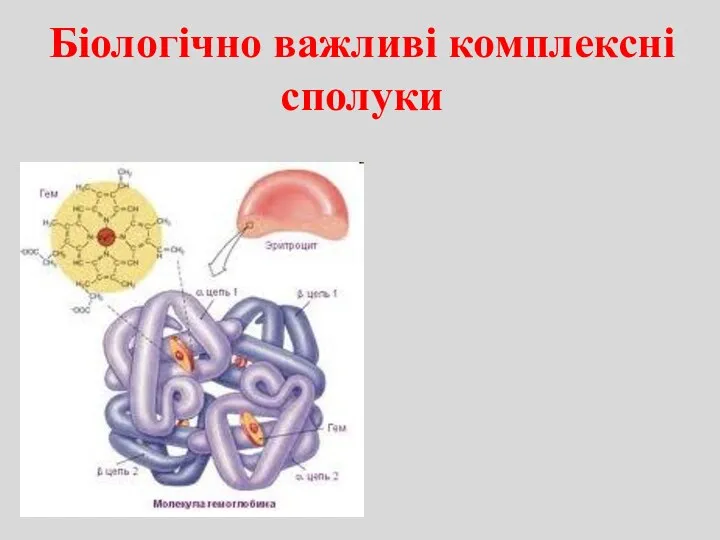
![К3 [Аl (ОH)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/580665/slide-2.jpg)

![К3 [Аl (ОH)6] В кожної комплексної сполуки розрізняють внутрішню і](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/580665/slide-4.jpg)

![Число атомів лігандів навколо центрального атома визначається координаційним числом комплексоутворювача К3 [Аl (ОH)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/580665/slide-6.jpg)
![К3 [Аl (ОH)6] [Cu (NH3)4] SO4 комплексний катіон комплексний аніон катіон аніон + -3 +2 -2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/580665/slide-7.jpg)

![К3 [Аl (ОH)6] К3 = +1 ·3 = +3 (ОH)6](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/580665/slide-9.jpg)
![[Cu (NH3)4] SO4 комплексна сполука Cu2+ - комплексоутворювач (центральний атом)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/580665/slide-10.jpg)


![[Cr (H2O) 6 ] Cl хром акво гекса хлорид гексааквохрому(ІІІ) хлорид](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/580665/slide-13.jpg)

 Оксид водорода (H2O)
Оксид водорода (H2O) Аллотропные модификации кремния
Аллотропные модификации кремния Способи очищення води в побуті
Способи очищення води в побуті Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Синтетические каучуки: хлоропреновый каучук
Синтетические каучуки: хлоропреновый каучук Химические элементы. Строение вещества. Химическая связь
Химические элементы. Строение вещества. Химическая связь Химическая кинетика
Химическая кинетика Металлы и неметаллы
Металлы и неметаллы Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Органикалық қосылыстар
Органикалық қосылыстар Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени
Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени Знакомство с лабораторным оборудованием
Знакомство с лабораторным оборудованием Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Химические свойства серной кислоты
Химические свойства серной кислоты Лекция 1 эквивалент 2
Лекция 1 эквивалент 2 Алканы. Состав, строение, свойства и химические превращения. Экологические последствия. Синтезы генетическая связь
Алканы. Состав, строение, свойства и химические превращения. Экологические последствия. Синтезы генетическая связь Реакции ионного обмена
Реакции ионного обмена Introduction in bioorganic chemistry. Isomerism and structure of organic compounds
Introduction in bioorganic chemistry. Isomerism and structure of organic compounds Классификация химических реакций. Признаки химических реакций
Классификация химических реакций. Признаки химических реакций Классы неорганических соединений
Классы неорганических соединений Химическая промышленность России
Химическая промышленность России Галогенопроизводные углеводородов
Галогенопроизводные углеводородов ПВХ
ПВХ Вугдеводи. Моносахариди
Вугдеводи. Моносахариди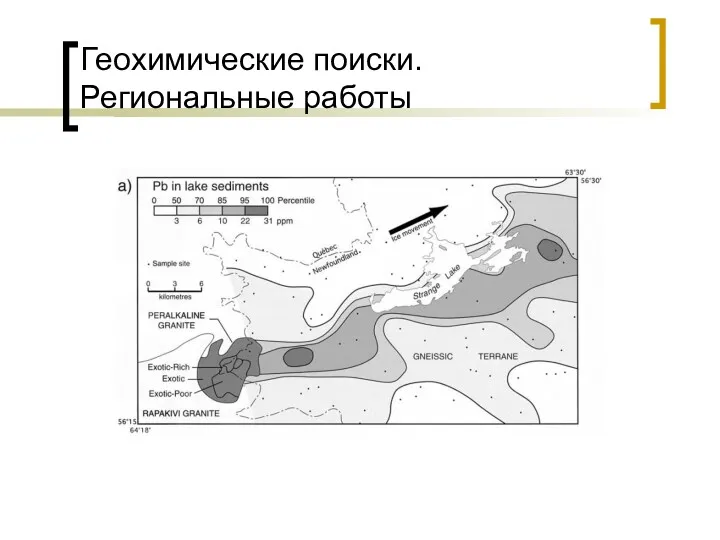 Геохимические поиски. Региональные работы
Геохимические поиски. Региональные работы Соединения алюминия
Соединения алюминия Альтернативная бытовая химия
Альтернативная бытовая химия Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены