Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени презентация
Содержание
- 2. План лекции 1. Химическое равновесие с позиции кинетики 2. Теория Аррениуса, энергия активации 3. Катализ
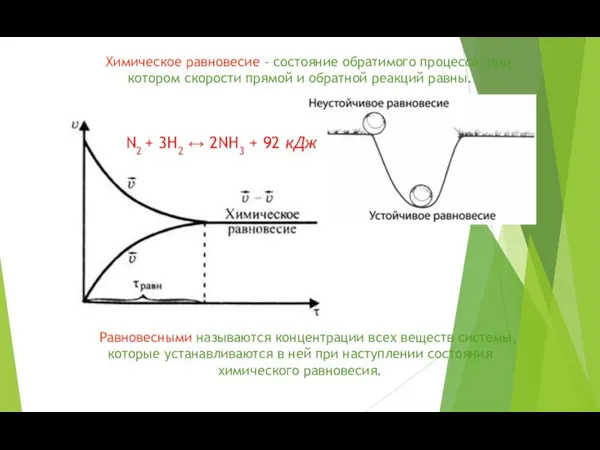
- 4. Химическое равновесие - состояние обратимого процесса, при котором скорости прямой и обратной реакций равны. Равновесными называются
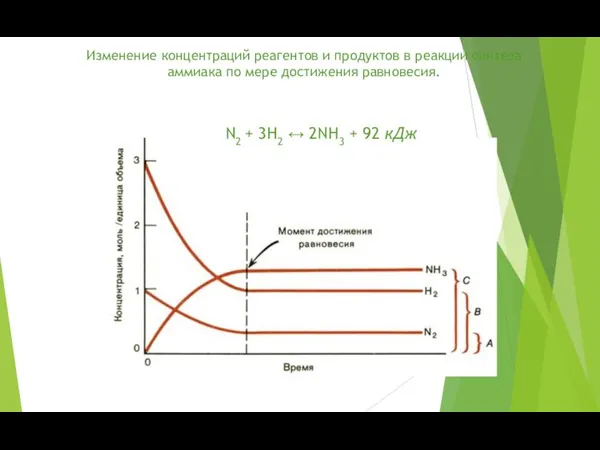
- 5. Изменение концентраций реагентов и продуктов в реакции синтеза аммиака по мере достижения равновесия. N2 + 3H2
- 6. Вывод константы химического равновесия В состоянии химического равновесия: ГУЛЬДБЕРГ Като Максимилиан (2.08.1836-14.1.1902)
- 7. Константа химического равновесия - отношение произведения равновесных концентраций конечных продуктов к произведению равновесных концентраций исходных веществ,
- 8. Смещение химического равновесия. Анри Ле-Шателье (8.10.1850 – 17.09.1936) Принцип Ле Шателье Если на систему, находящуюся в
- 9. Студенты Сорбонны, слушавшие лекции Ле-Шателье в 1907-1908 годах, так записывали в своих конспектах: "Изменение любого фактора,
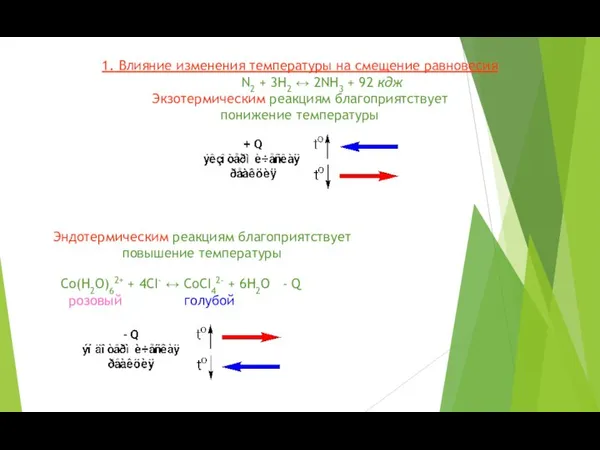
- 10. 1. Влияние изменения температуры на смещение равновесия N2 + 3H2 ↔ 2NH3 + 92 кдж Экзотермическим
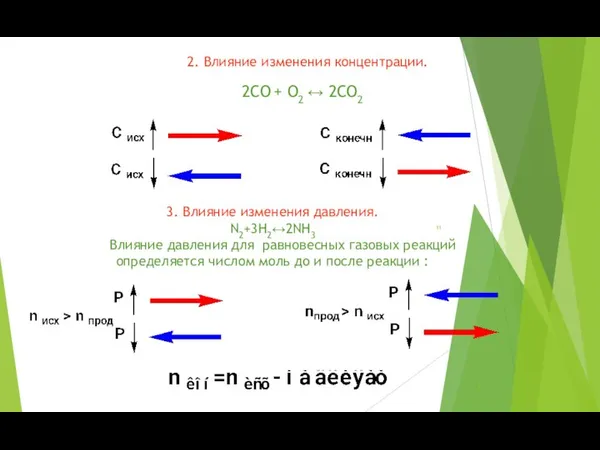
- 11. 2. Влияние изменения концентрации. 2СО + О2 ↔ 2СО2 3. Влияние изменения давления. N2+3H2↔2NH3 Влияние давления
- 12. Теория активации Аррениуса Хим. реакция может происходить только при столкновении активных частиц, т.е. тех, которые обладают
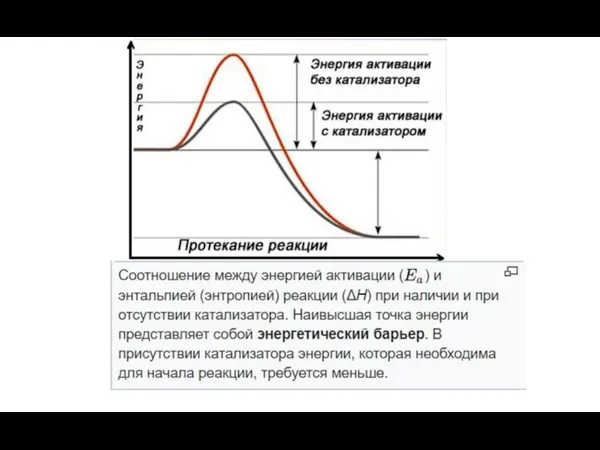
- 13. Энергия активации (Еа, кДж/моль) – это избыточный запас энергии молекулы над средне статистическим запасом энергии, позволяющий
- 14. Cогласно молекулярно-кинетической теории газов для каждой системы существует порог энергии Еа , начиная с которого энергия
- 15. Энергия активации - минимальное количество энергии, которое требуется сообщить системе (джоуль на моль), чтобы произошла реакция.
- 16. Молекулы должны столкнуться. Это важное условие, однако его не достаточно, так как при столкновении не обязательно
- 17. При низкой (для определённой реакции) температуре большинство молекул обладают энергией меньшей, чем энергия активации, и неспособны
- 18. Уравнение Аррениуса устанавливает связь между энергией активации и скоростью протекания реакции: k — константа скорости реакции,
- 19. Для количественного описания температурных эффектов в химической кинетике для приближённых вычислений кроме уравнения Аррениуса используют правило
- 20. Еа - велика, скорость реакции – мала Еа – мала, скорость – велика Уравнение Аррениуса
- 21. ПРЕДЭКСПОНЕНТА И ЭКСПОНЕНТА Предэкспоненциальный множитель (А) дает некоторую характеристику полного числа столкновений доля результативных столкновений
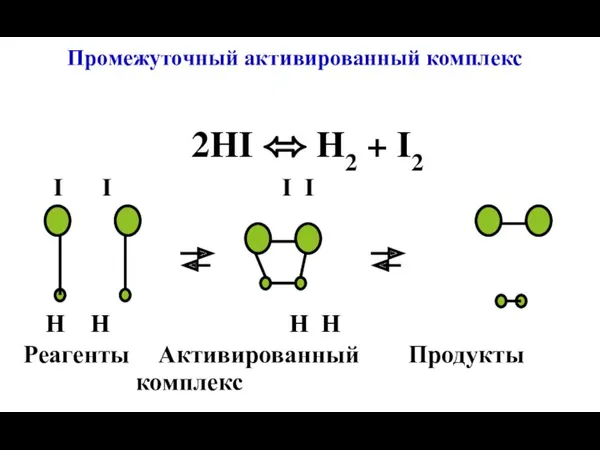
- 22. Переходное состояние — состояние системы, при котором уравновешены разрушение и создание связи. В переходном состоянии система
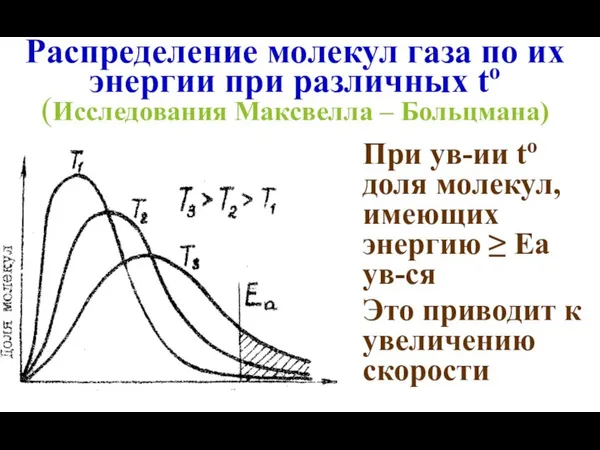
- 24. Распределение молекул газа по их энергии при различных to (Исследования Максвелла – Больцмана) При ув-ии to
- 25. ЕIа А…В – активир. комплекс Е1, Е2,,,, Е3 - средняя энергия молекул реагентов, продуктов, переходного состояния
- 26. Промежуточный активированный комплекс 2HI ⬄ H2 + I2 I I I I H H H H
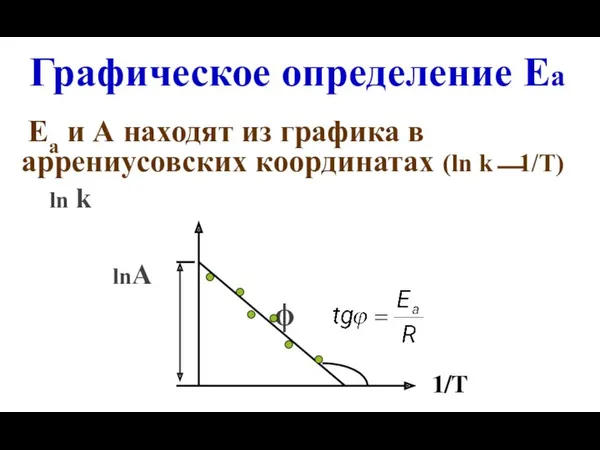
- 27. Определение энергии активации
- 28. Графическое определение Еа Еа и А находят из графика в аррениусовских координатах (ln k⎯1/Т) ln k
- 29. Способы активации молекул термический светом ионизирующее излучение γ, - излучение корпускулярные и др. механохимическая звуковая активация
- 30. Катализ
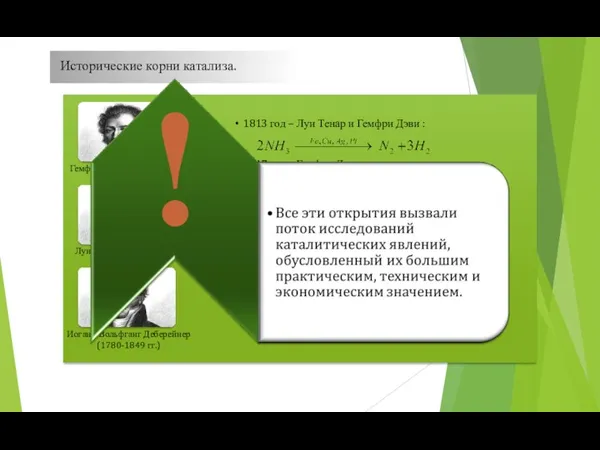
- 31. . Исторические корни катализа.
- 32. Исторические корни катализа. Две эти работы имели огромное прикладное значение! Именно они инициировали поиск веществ, стимулирующих
- 33. Исторические корни катализа.
- 34. Становление теории катализа. Эйльхард Альфред Митчерлих (1794 – 1863 гг.) в 1833 году вводит понятие «контактной
- 35. Определение катализа. Георгий Константинович Боресков (1907-1984 гг.): «Феноменологически катализ можно определить как возбуждение химических реакций или
- 36. Катализ – это явление ускорения реакции под действием веществ не расходующихся в реакции Каталитические реакции –
- 37. Катализатор – это вещество, которое многократно участвует в промежуточных стадиях реакции, но выходит из нее химически
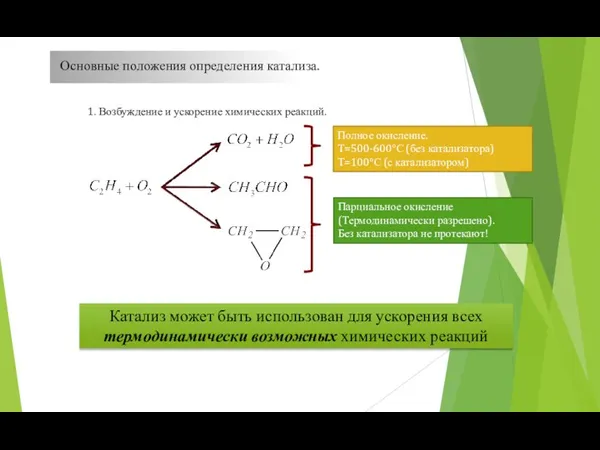
- 38. Основные положения определения катализа. 1. Возбуждение и ускорение химических реакций. Полное окисление. Т=500-600°С (без катализатора) Т=100°С
- 39. Основные положения определения катализа. 2. Промежуточное химическое взаимодействие. 3. Катализатор не расходуется в процессе реакции. Катализ
- 40. Основные положения определения катализа. 5. Малое количество катализатора может преобразовать громадные количества вещества. 6. Катализатор не
- 41. Катализатор. Катализатор – вещество (индивидуальное химическое соединение или их смесь), присутствие которого в смеси реагентов приводит
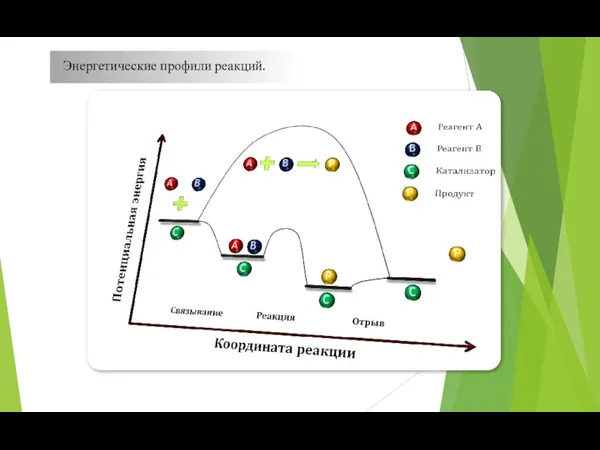
- 42. Энергетические профили реакций.
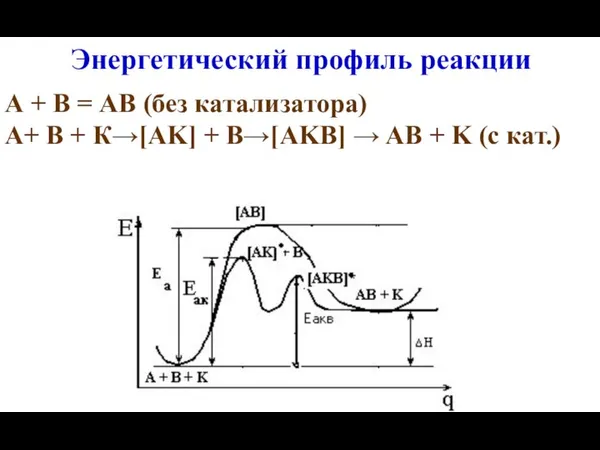
- 43. Энергетический профиль реакции А + В = АВ (без катализатора) А+ В + К→[AK] + В→[AKB]
- 44. Активный центр катализатора.
- 45. Классификация катализаторов. 1. Катализатор может быть как индивидуальным веществом, так и смесью веществ. однокомпонентные: металлы, окислы,
- 46. Гомогенный катализ (кат-р и реагент образуют одну фазу) Пример: получение SO3 окислением SO2 в технологии получения
- 47. Гетерогенный катализ Получение H2SO4 с помощью Pt кат-ра SO2 (г) + 1/2О2 (г) = SO3 (г)
- 48. Типы каталитических систем. * Смешивающиеся жидкости * * Хорошо растворимы в жидкости
- 49. Типы каталитических систем. Ферментативный катализ
- 51. Скачать презентацию




































 Люминесцентный анализ
Люминесцентный анализ Термодинамика химических процессов
Термодинамика химических процессов Вcтуп до курсу Класифікації отрут і отруєнь. Токсикометрія
Вcтуп до курсу Класифікації отрут і отруєнь. Токсикометрія Полимеры (10 класс)
Полимеры (10 класс) Периодический закон и периодическая система химических элементов
Периодический закон и периодическая система химических элементов Серная кислота и её свойства
Серная кислота и её свойства Индикаторы кислотно-основного титрования
Индикаторы кислотно-основного титрования Высокомолекулярные соединения. Общий курс
Высокомолекулярные соединения. Общий курс Химическая промышленность
Химическая промышленность Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості
Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості Азотовмісні сполуки
Азотовмісні сполуки Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Хімічні властивості кислот
Хімічні властивості кислот Основные этапы первичного процесса переработки нефти
Основные этапы первичного процесса переработки нефти Методика преподавания химии
Методика преподавания химии Отчет по исследовательской работе Образование АСПО
Отчет по исследовательской работе Образование АСПО Закон сохранения массы веществ. Урок вместе с умной колонкой
Закон сохранения массы веществ. Урок вместе с умной колонкой Получение и применение алканов
Получение и применение алканов Розв'язування задач за рівнянням хімічних реакцій
Розв'язування задач за рівнянням хімічних реакцій Кислород/водород. Повторение
Кислород/водород. Повторение История открытия химических веществ
История открытия химических веществ Некоторые структурные особенности макромолекул
Некоторые структурные особенности макромолекул 20231009_zhyostkost_vody
20231009_zhyostkost_vody Сложные эфиры. 10 класс
Сложные эфиры. 10 класс Элементтер-органогендер. Көміртек – органикалық қосылыстардың негізін құраушы. Тірі және өлі табиғат арасындағы шекара
Элементтер-органогендер. Көміртек – органикалық қосылыстардың негізін құраушы. Тірі және өлі табиғат арасындағы шекара Железо и его соединения
Железо и его соединения Особенности сжигания жидкого топлива и топливосжигающие устройства
Особенности сжигания жидкого топлива и топливосжигающие устройства Алкандар. Метан молекуласының құрылысы Метан және оның гомологтарының қасиеттері
Алкандар. Метан молекуласының құрылысы Метан және оның гомологтарының қасиеттері