Содержание
- 2. История открытия: Теллур был найден в 1782 году в золотоносных рудах Трансильвании горным инспектором Францем Йозефом
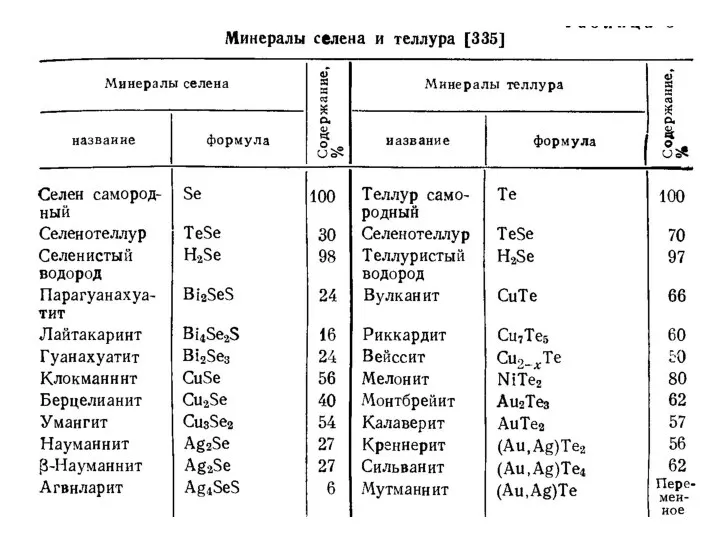
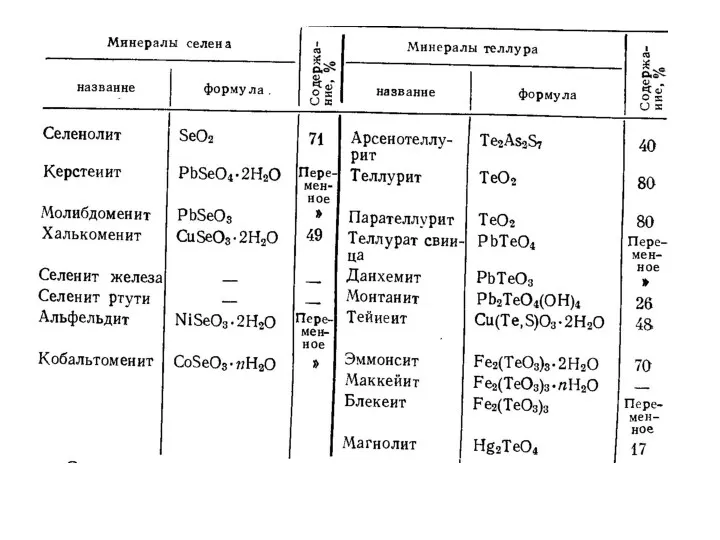
- 6. Некоторые минералы селена Ядарит формула LiNaSiB3O7(OH) Науманит формула Ag2Se Берцелианит формула Cu2Se Некоторые минералы теллура Жозеит-А
- 7. ОСНОВНЫЕ ХИМИЧЕСКИЕ СОЕДИНЕНИЯ СЕЛЕНА И ТЕЛЛУРА По химическим свойствам селен и теллур в общем похожи на
- 8. Разбавленные соляная и серная кислоты на селен не действуют. В смеси азотной и соляной кислот селен
- 9. При комнатной температуре и при 60—70° С селен и теллур в NaOH и КОН растворяются очень
- 10. Основные реакции селена Хлорная известь
- 11. Водные растворы солей серебра, золота и аналогичных им элементов с селеном реагируют следующим образом: Ниже приводятся
- 12. В противоположность производным четырехвалентной серы (SO2, H2SO3, Na2SO3, NaHSO3), для которых характерны восстановительные свойства, SeO2, H2SeO3
- 13. Что касается производных шестивалентного селена (H2SeO4 и ее соли), то они, хотя и являются также окислителями,
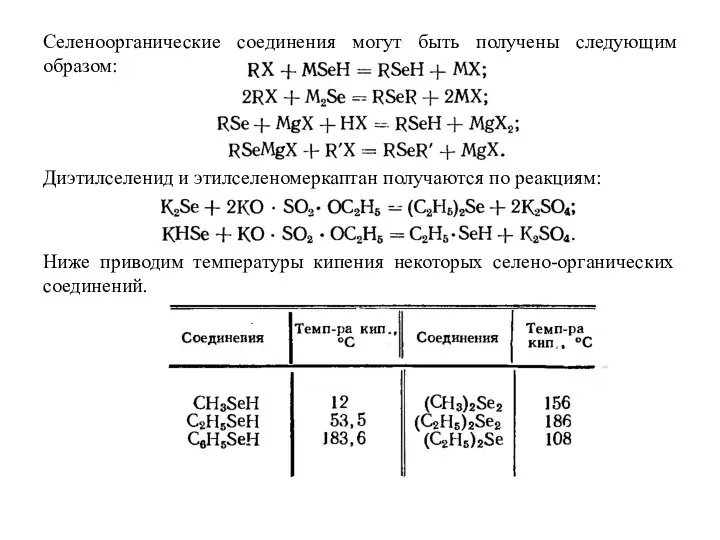
- 14. Селеноорганические соединения могут быть получены следующим образом: Диэтилселенид и этилселеномеркаптан получаются по реакциям: Ниже приводим температуры
- 15. Основные реакции теллура По химическим свойствам теллур похож на селен, но имеет более резко выраженные металлические
- 16. Элементарный (металлический) теллур реагирует с водой при 100—160° (а свежеосажденный при обычных условиях): Теллур не растворяется
- 17. В концентрированных щелочах теллур подвергается реакции диспропорционирования (самоокисления — самовосстановления) : Хлором (и бромом) теллур окисляется:
- 18. Ниже приводятся дополнительно уравнения реакций, в которых теллур проявляет не только восстановительные, но и окислительные свойства:
- 19. Характерным свойством теллура является легкость восстановления двуокиси теллура, теллуристой кислоты и ее солей: Однако сильными окислителями
- 20. Шести положительно-валентные соединения теллура, проявляя окислительные свойства, восстанавливаются до элементарного состояния или до положительно четырехвалентного: К
- 21. Действие некоторых восстановителей на соединения теллура отличается от действия на аналогичные соединения селена, на основании чего
- 23. Скачать презентацию

















 Удивительные свойства воды
Удивительные свойства воды Electronică aplicată. (Curs 2)
Electronică aplicată. (Curs 2) Пространственное строение органических соединений. (Лекция 2)
Пространственное строение органических соединений. (Лекция 2) 20230416_urok_na_20.02.2023
20230416_urok_na_20.02.2023 Неізогіпсичні перетворення функціональних груп. Реакції окиснення
Неізогіпсичні перетворення функціональних груп. Реакції окиснення Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Электронная конфигурация К. Классификация химических элементов. 8 класс
Электронная конфигурация К. Классификация химических элементов. 8 класс Спирты. Физические и химические свойства
Спирты. Физические и химические свойства Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування
Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування 20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii
20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii Классификация органических соединений, углеводородов
Классификация органических соединений, углеводородов Типовые процессы технологии неорганических веществ. (Тема 3)
Типовые процессы технологии неорганических веществ. (Тема 3) ЕГЭ Химия. Задание №5
ЕГЭ Химия. Задание №5 Изучение строения и свойств глюкозы
Изучение строения и свойств глюкозы Железо и его соединения
Железо и его соединения Химические превращения веществ
Химические превращения веществ Белки. Функции белков
Белки. Функции белков Високомолекулярні сполуки. Полімери
Високомолекулярні сполуки. Полімери Простые спектры 1Н ЯМР
Простые спектры 1Н ЯМР Значення хімічних процесів у природі
Значення хімічних процесів у природі Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас Реакции ионного обмена
Реакции ионного обмена Жиры. Мыла. 10 класс
Жиры. Мыла. 10 класс Группа редкоземельных элементов
Группа редкоземельных элементов Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі
Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі Железо
Железо Crystallography. Part 4: Crystal Forms Twinning
Crystallography. Part 4: Crystal Forms Twinning Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)
Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)