Амины. Общая характеристика, номенклатура, изомерия. Получение. Физико-химические свойства. Отдельные представители презентация
Содержание
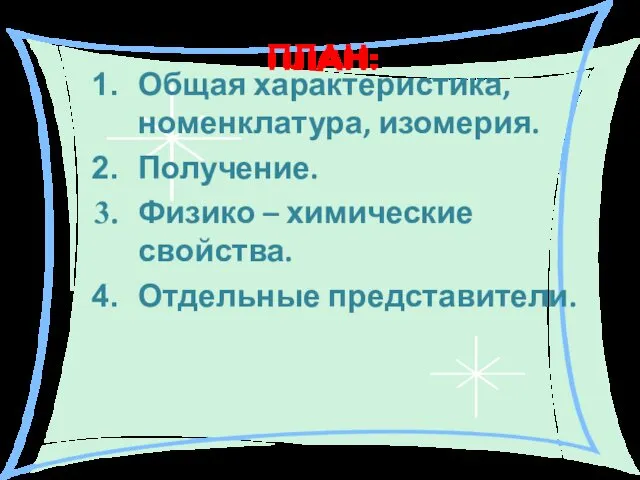
- 2. ПЛАН: Общая характеристика, номенклатура, изомерия. Получение. Физико – химические свойства. Отдельные представители.
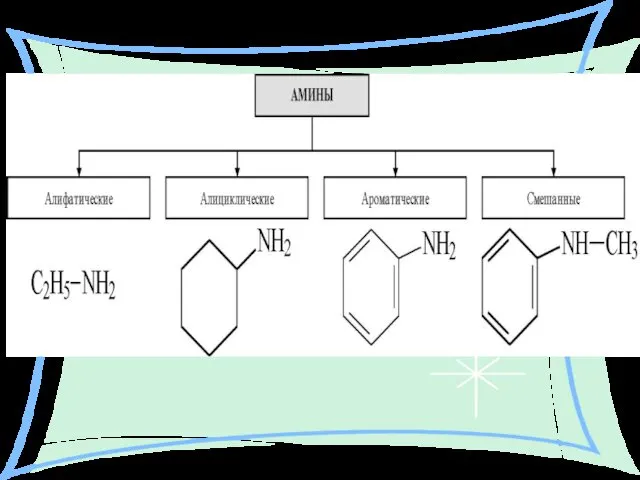
- 3. АМИНЫ – Производные аммиака, в молекуле которого атомы водорода (один, два или три) замещены на углеводородные
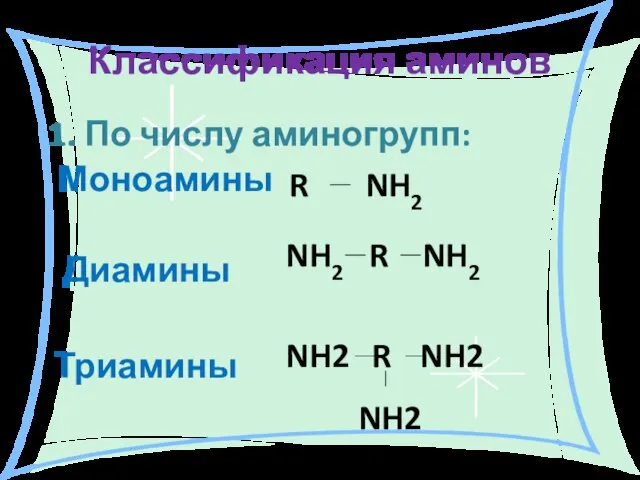
- 5. Классификация аминов 1. По числу аминогрупп: Моноамины R NH2 Диамины NH2 R NH2 Триамины NH2 R
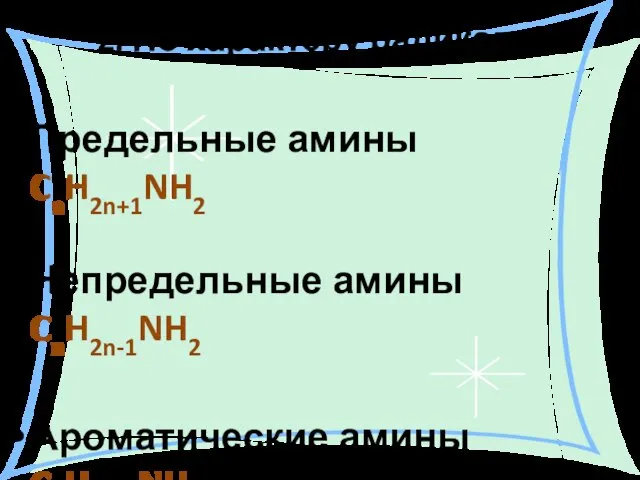
- 6. 2. По характеру радикала: Предельные амины CnH2n+1NH2 Непредельные амины CnH2n-1NH2 Ароматические амины CnH2n-7NH2
- 7. Номенклатура аминов (рациональная) За основу берут название углеводородного радикала с прибавлением суффикса -амин
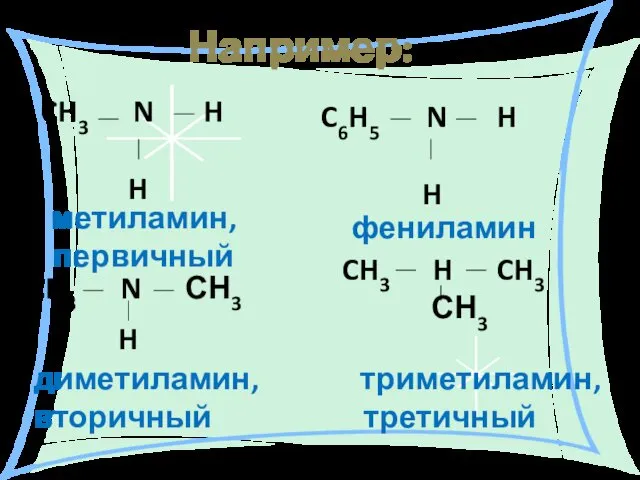
- 8. Например: CH3 N H H CH3 N СН3 H C6H5 N H H метиламин, первичный диметиламин,
- 9. Номенклатура аминов (международная) К названию углеводорода добавляют слово -амин и в конце цифрой указывают атом углерода,
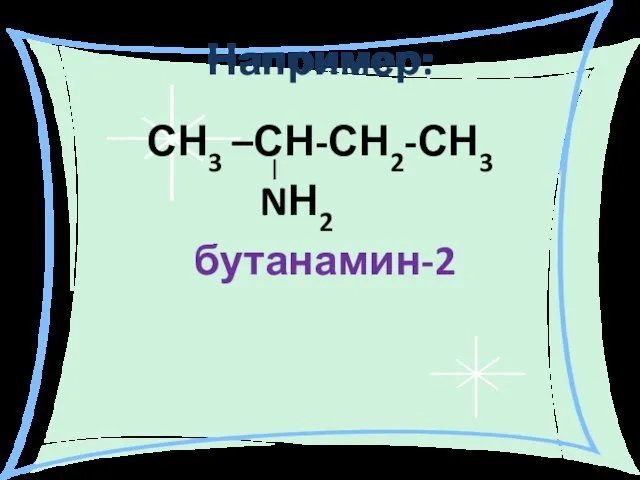
- 10. Например: СН3 –СН-СН2-СН3 NН2 бутанамин-2
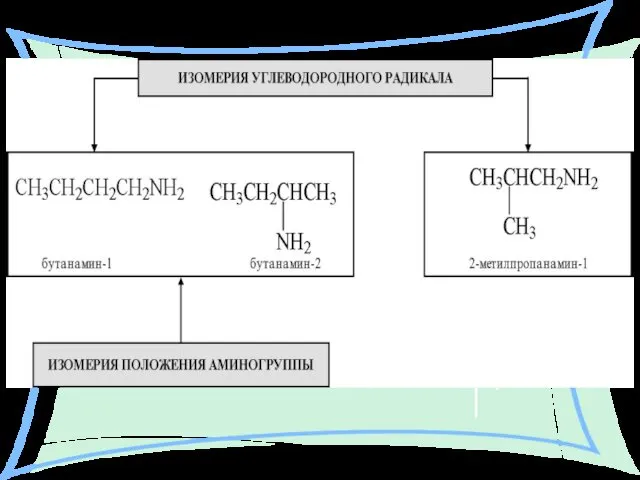
- 11. ИЗОМЕРИЯ: Строения углеродного скелета (радикала). Положения аминогруппы
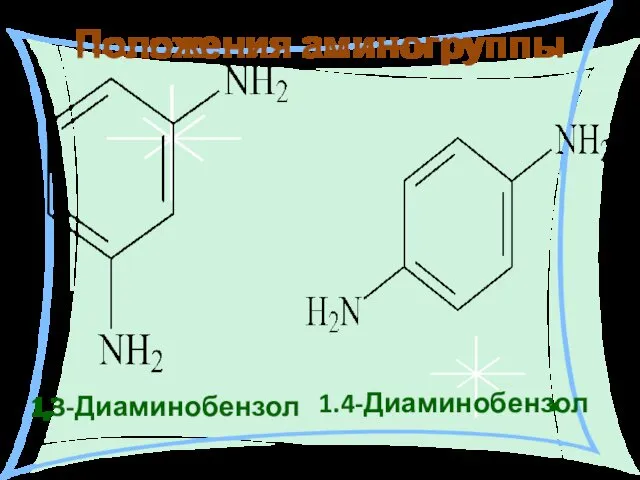
- 13. 1,3-Диаминобензол 1.4-Диаминобензол Положения аминогруппы
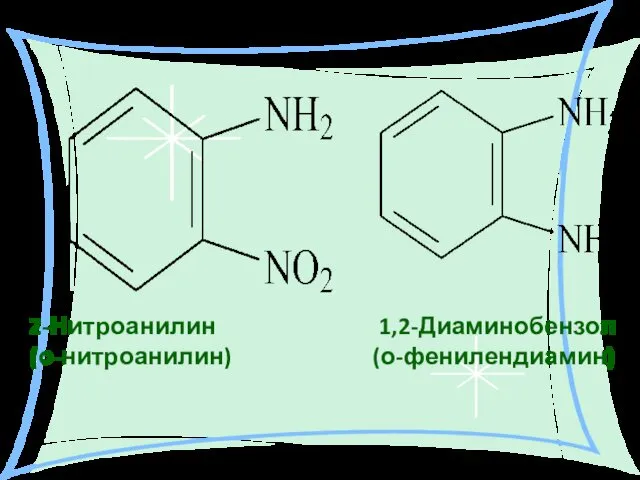
- 14. 2-Нитроанилин 1,2-Диаминобензол (о-нитроанилин) (о-фенилендиамин)
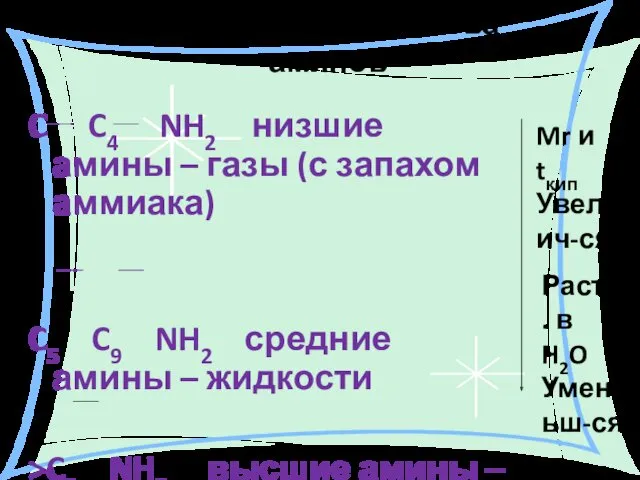
- 15. Физические свойства аминов C C4 NH2 низшие амины – газы (с запахом аммиака) C5 C9 NH2
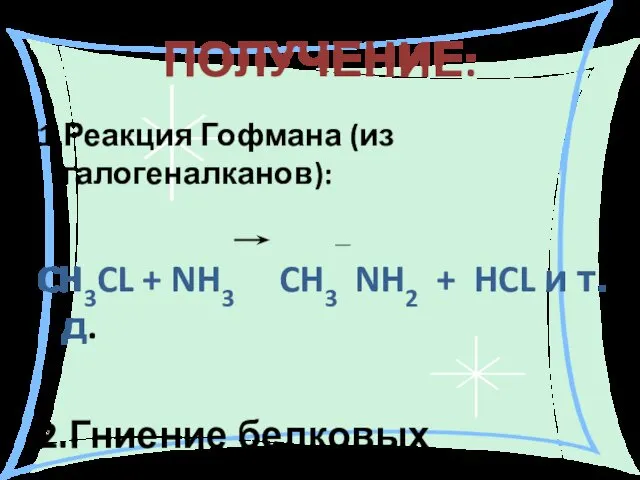
- 16. ПОЛУЧЕНИЕ: 1.Реакция Гофмана (из галогеналканов): CH3CL + NH3 CH3 NH2 + HCL и т.д. 2.Гниение белковых
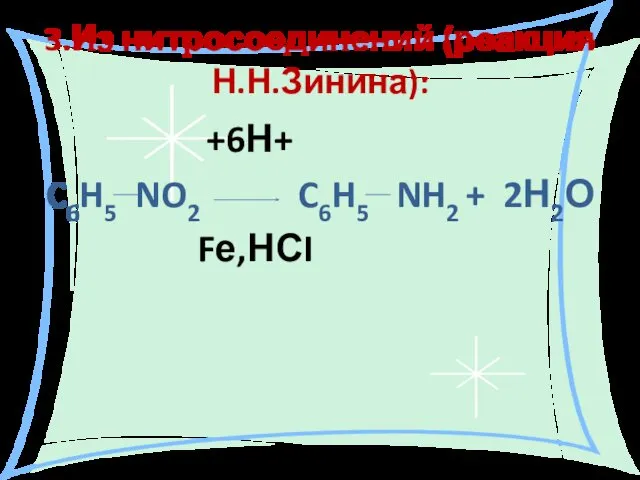
- 17. 3.Из нитросоединений (реакция Н.Н.Зинина): +6Н+ C6H5 NO2 C6H5 NH2 + 2Н2О Fе,НСI
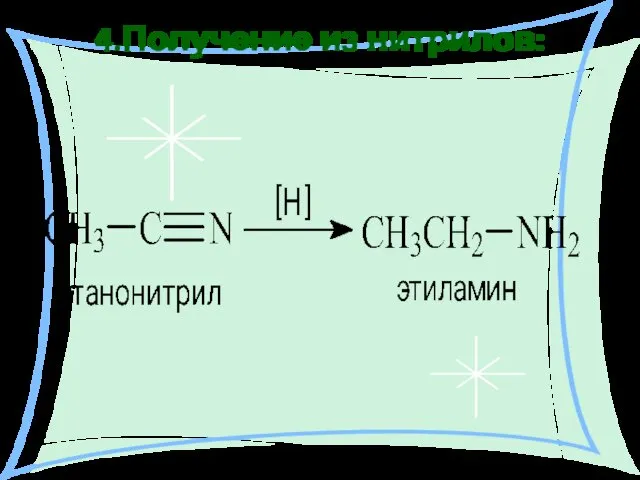
- 18. 4.Получение из нитрилов:
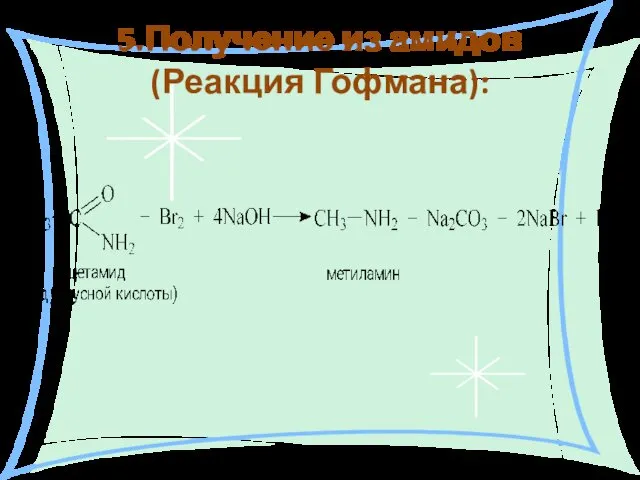
- 19. 5.Получение из амидов (Реакция Гофмана):
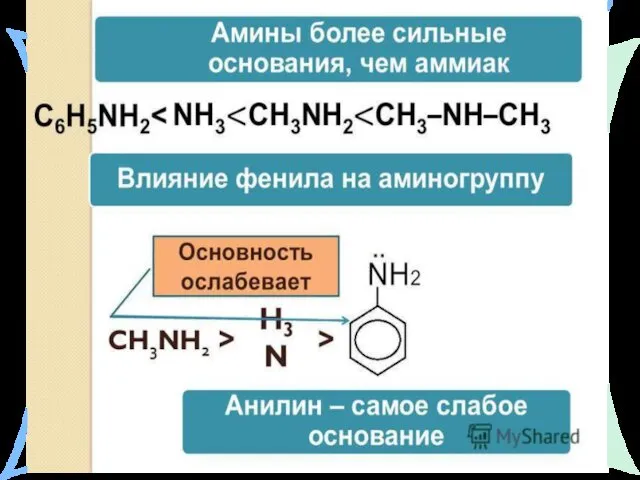
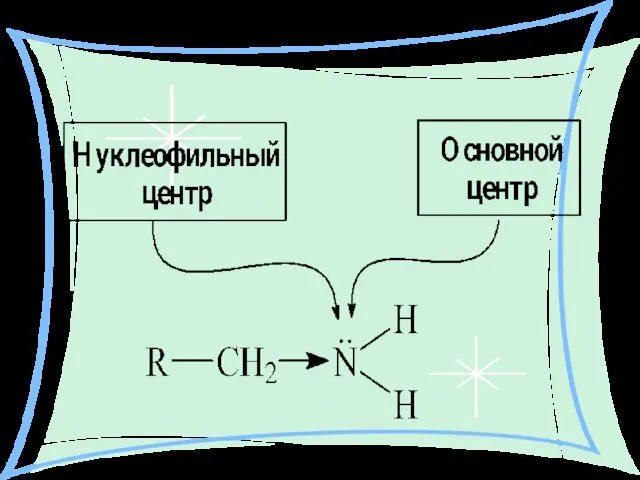
- 20. Химические свойства: Амины – как и аммиак проявляют ярко выраженные свойства оснований, что обусловлено наличием в
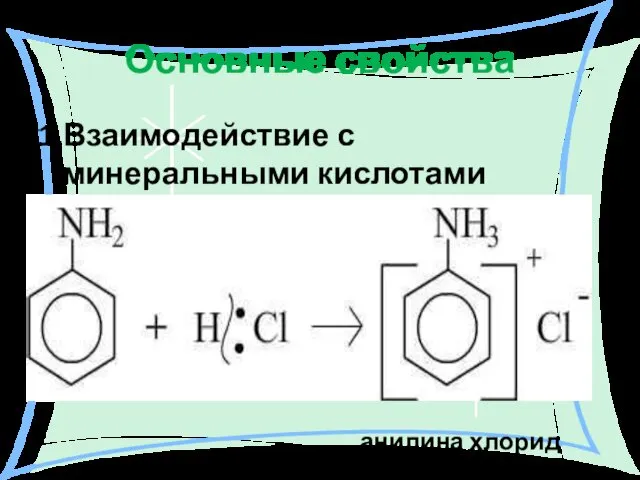
- 23. Основные свойства 1.Взаимодействие с минеральными кислотами анилина: анилина хлорид
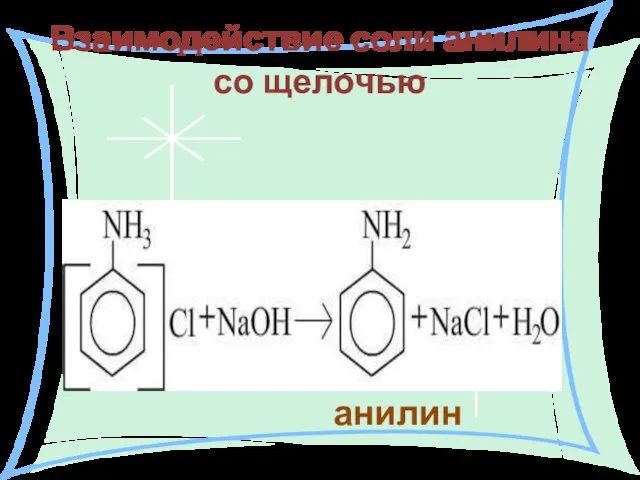
- 24. Взаимодействие соли анилина со щелочью анилин
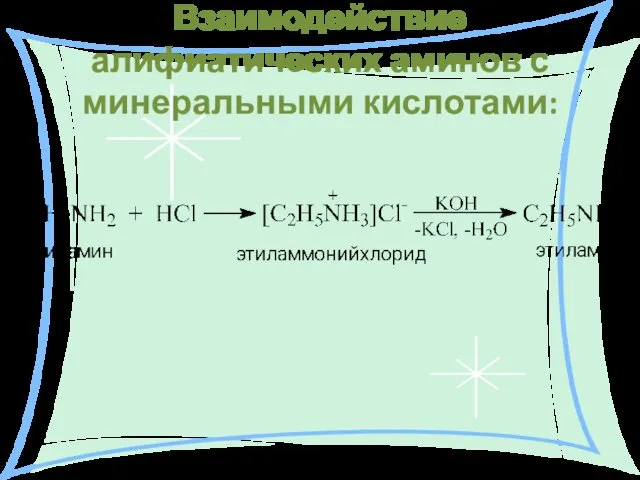
- 25. Взаимодействие алифиатических аминов с минеральными кислотами:
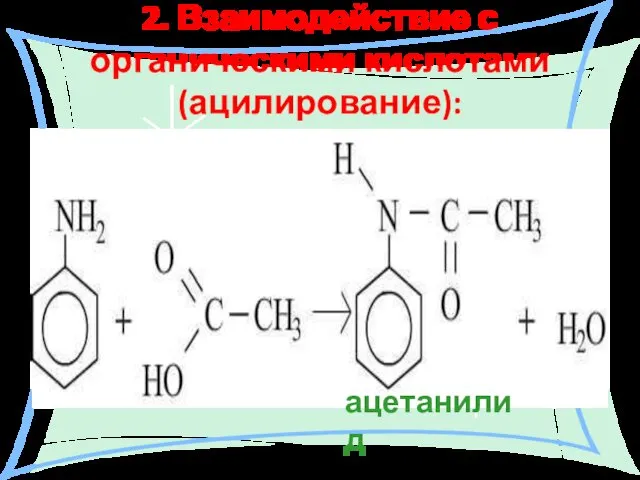
- 26. 2. Взаимодействие с органическими кислотами (ацилирование):
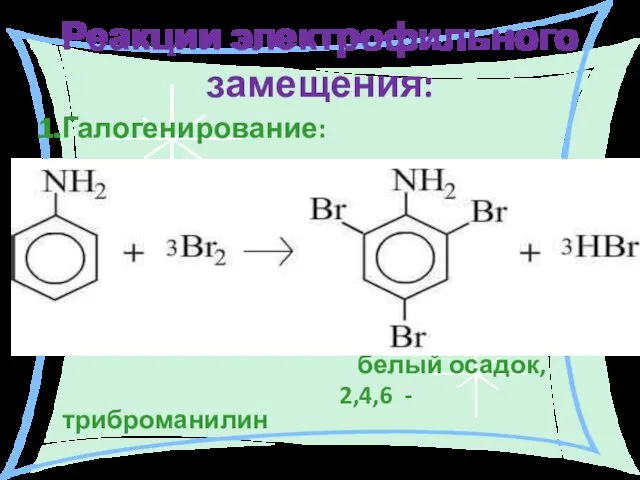
- 27. Реакции электрофильного замещения: 1.Галогенирование: белый осадок, 2,4,6 - триброманилин
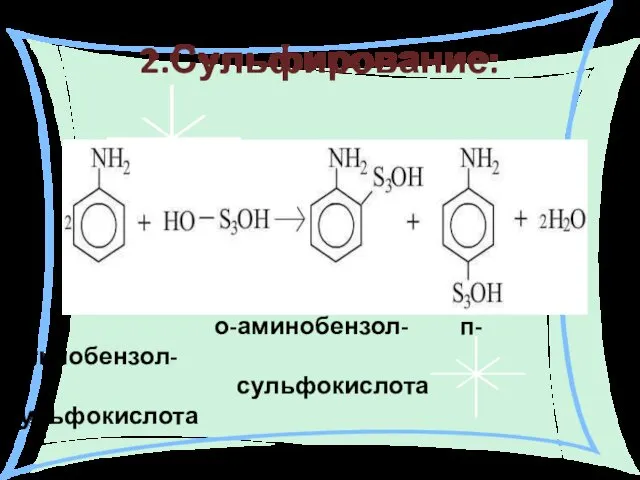
- 28. 2.Сульфирование: о-аминобензол- п-аминобензол- сульфокислота сульфокислота
- 29. 3.Реакция диазотирования: C6H5NH2+NaNO2+2HCl [C6H5-N≡N]+Cl- +NaCl + 2H2O хлорид диазония
- 30. АНИЛИН (С6Н5NН2)- Бесцветная маслянистая жидкость со своеобразным запахом, тяжелее воды, плохо в ней растворяется. Ядовит. Применяется
- 31. Качественные реакции на анилин: С бромной водой –выпадает осадок белого цвета 2,4,6 триброманилин. С лигнином в
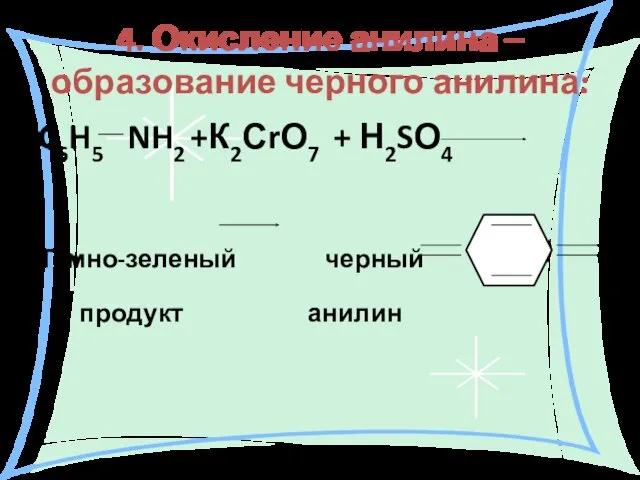
- 32. 4. Окисление анилина – образование черного анилина: C6H5 NH2 +К2СrО7 + Н2SО4 Темно-зеленый черный продукт анилин
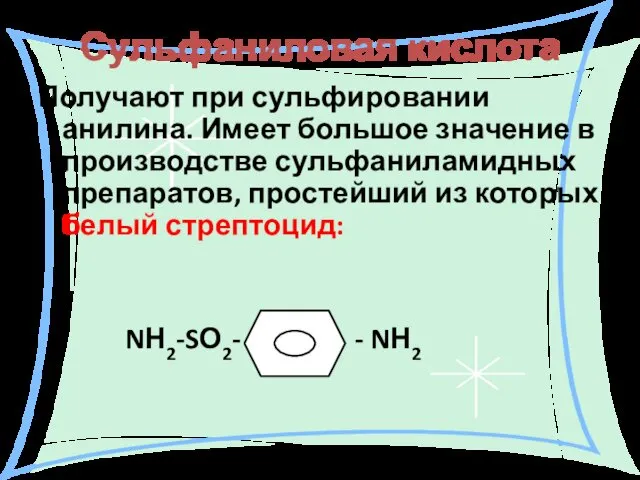
- 33. Сульфаниловая кислота Получают при сульфировании анилина. Имеет большое значение в производстве сульфаниламидных препаратов, простейший из которых
- 34. Сульфаниламидные препараты – препараты антибактериального действия, применяются при лечении, заболеваний вызванных стрептококками : ангина, рожистое воспаление,
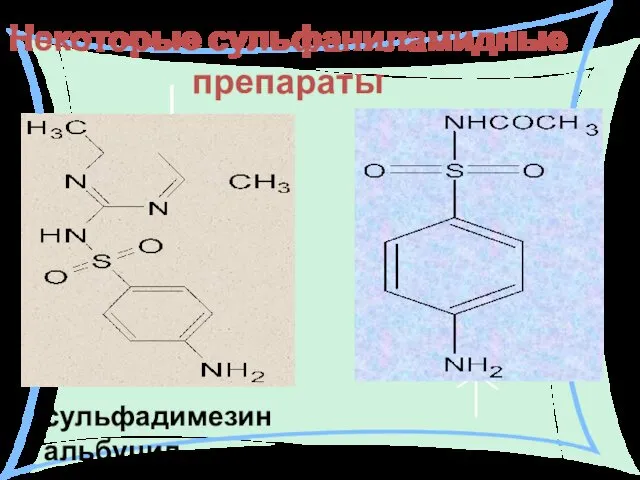
- 35. Некоторые сульфаниламидные препараты сульфадимезин альбуцид
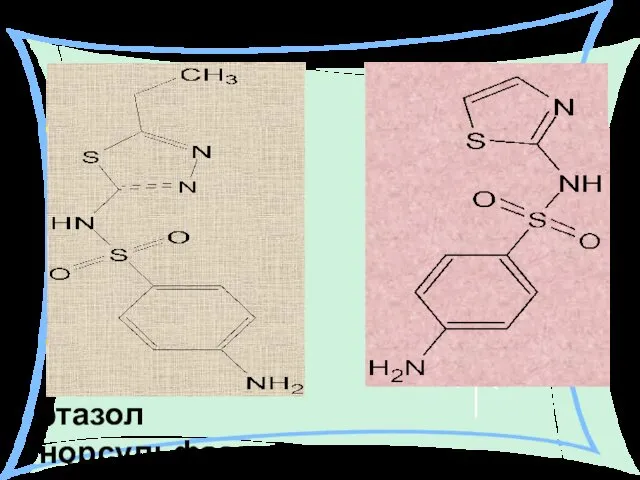
- 36. этазол норсульфазол
- 38. Скачать презентацию





![3.Реакция диазотирования: C6H5NH2+NaNO2+2HCl [C6H5-N≡N]+Cl- +NaCl + 2H2O хлорид диазония](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/24148/slide-28.jpg)



 Органическая химия в ряду других наук
Органическая химия в ряду других наук Типы химических реакций
Типы химических реакций Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Чистые вещества и смеси
Чистые вещества и смеси Металлы – простые вещества
Металлы – простые вещества Цинк и его соединения
Цинк и его соединения Особенности химического состава клетки
Особенности химического состава клетки Алкадиены. Диеновые углеводороды
Алкадиены. Диеновые углеводороды Пищевые добавки
Пищевые добавки Растворы. Приготовление растворов
Растворы. Приготовление растворов Группа редкоземельных элементов
Группа редкоземельных элементов Основы коррозии и защиты металлов. Методы исследования коррозии
Основы коррозии и защиты металлов. Методы исследования коррозии Взрывчатые вещества. Пероксид ацетона и пикриновая кислота
Взрывчатые вещества. Пероксид ацетона и пикриновая кислота Экспериментальные методы физико-химических исследований. Лекция 7
Экспериментальные методы физико-химических исследований. Лекция 7 Техника безопасности в химической лаборатории; основные виды лабораторной посуды и оборудования, 8 класс
Техника безопасности в химической лаборатории; основные виды лабораторной посуды и оборудования, 8 класс Самородные элементы
Самородные элементы Магия кристаллов
Магия кристаллов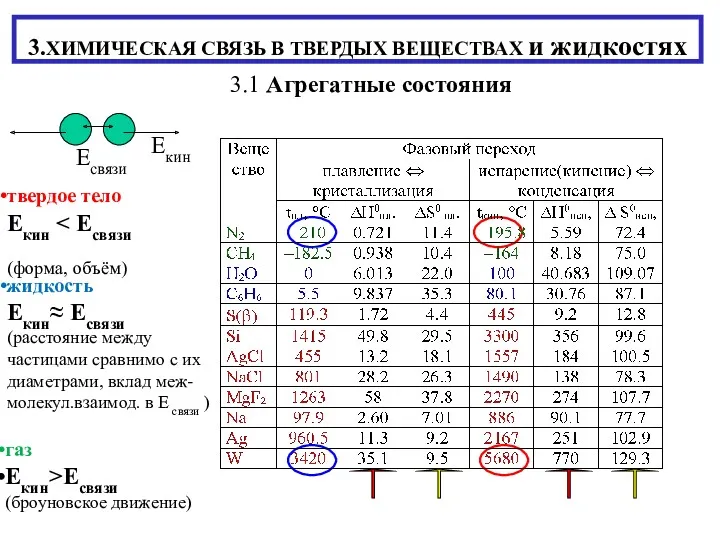 Химическая связь в твердых веществах и жидкостях
Химическая связь в твердых веществах и жидкостях Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі
Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі Реконструкция установки получения элементарной серы
Реконструкция установки получения элементарной серы Сильные и слабые электролиты. Кислотность среды. 9 класс
Сильные и слабые электролиты. Кислотность среды. 9 класс Электролитическая диссоциация
Электролитическая диссоциация Карбонові кислоти. Хімія. 9 клас
Карбонові кислоти. Хімія. 9 клас Алюминий и его соединения
Алюминий и его соединения Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Химия биогенных элементов p -блока
Химия биогенных элементов p -блока Общая теория протолитических равновесий и процессов. Буферные системы
Общая теория протолитических равновесий и процессов. Буферные системы Равновесие в реакциях гидролиза. Лекция 6
Равновесие в реакциях гидролиза. Лекция 6