Содержание
- 2. 30Zn 1s22s22p63s23p64s23d10 d-элемент IV-го периода второй группы побочной подгруппы Zn Строение
- 3. Нахождение в природе По содержанию в земной коре цинк занимает 23-место среди других элементов (0,01%). Обычно
- 4. Получение 1)Пирометаллургический способ: 2 ZnS+ 3O2 = 2 ZnO + SO2 ZnO + C = Zn
- 5. Физические свойства Является амфотерным металлом. Цвет – синевато-белый, имеет сильный металлический блеск. Плотность – 7,13 г/см3
- 6. Химические свойства При взаимодействии с О2 – окисляется (покрывается оксидной пленкой) Взаимодействует с простыми веществами (с
- 7. Взаимодействие цинка с простыми веществами 2Zn + O2 2ZnO Zn + S ZnS Zn + СI2
- 8. Zn + 2NaOH + 2H2O Na2 [Zn(OH)4] + H2 Zn + H3PO4 ZnHPO4 + H2 Zn
- 9. Применение Как антикоррозийное покрытие. Изготовление гальванических элементов. Как восстановитель в гидрометаллургических процессах способствующих извлечению многих ценных
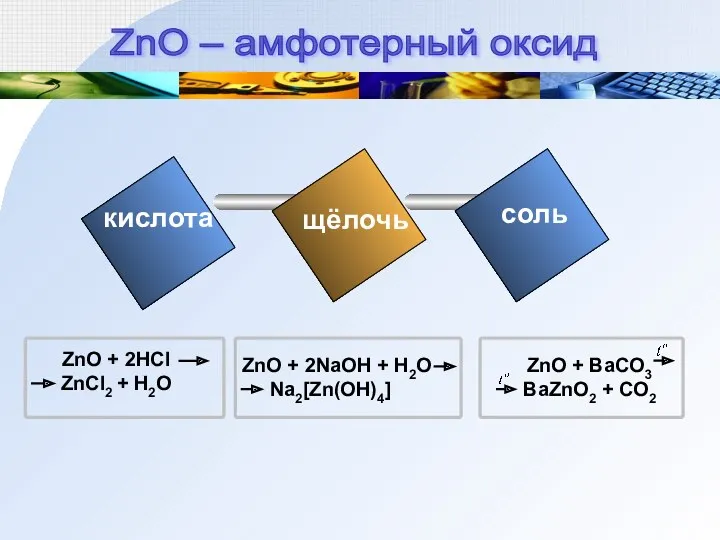
- 10. кислота щёлочь соль ZnO – амфотерный оксид
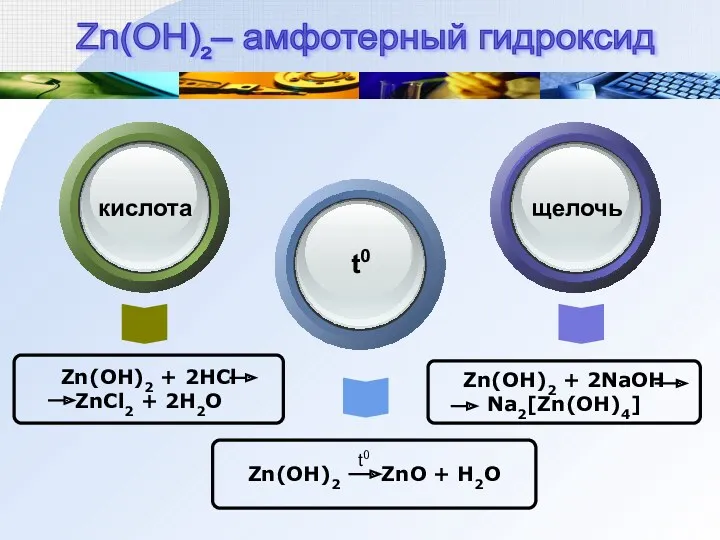
- 11. Zn(OH)2 + 2HCl ZnCl2 + 2H2O Zn(OH)2 ZnO + H2O Zn(OH)2 + 2NaOH Na2[Zn(OH)4] кислота Text
- 13. Скачать презентацию






![Zn + 2NaOH + 2H2O Na2 [Zn(OH)4] + H2 Zn](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/391870/slide-7.jpg)

 Титриметрический метод анализа
Титриметрический метод анализа Лекция 3. Разновидности химических связей
Лекция 3. Разновидности химических связей Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною
Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною Природные источники углеводородов и их переработка
Природные источники углеводородов и их переработка Хімічні явища в побуті
Хімічні явища в побуті Железо и его свойства
Железо и его свойства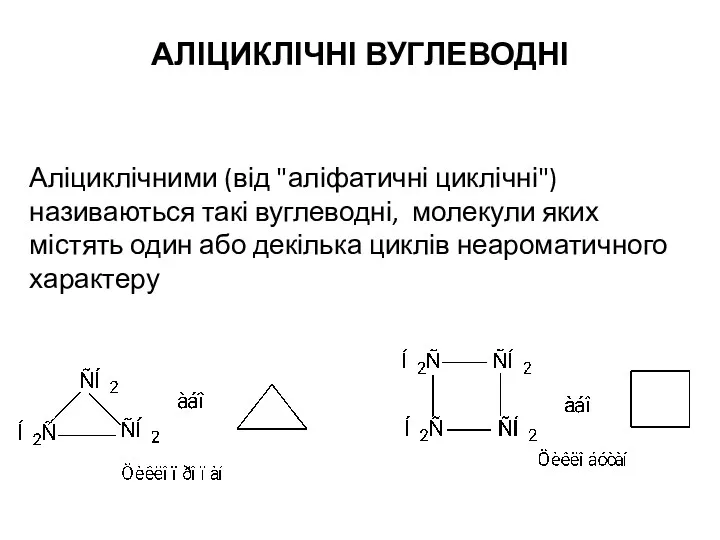 Аліциклічні вуглеводні
Аліциклічні вуглеводні Соединения серы
Соединения серы Соединения кальция. Жесткость воды и способы её устранения
Соединения кальция. Жесткость воды и способы её устранения Конструкционные функциональные волокнистые композиты. Стеклопластики
Конструкционные функциональные волокнистые композиты. Стеклопластики Удивительные свойства воды
Удивительные свойства воды Азотсодержащие органические соединения. Амины. Анилинароматический амин
Азотсодержащие органические соединения. Амины. Анилинароматический амин Романенко
Романенко Извлечение из растворов экстракцией органическими растворителями
Извлечение из растворов экстракцией органическими растворителями Бета-окисление жирных кислот
Бета-окисление жирных кислот Дизельное топливо. Требования, предъявляемые к дизельным топливам
Дизельное топливо. Требования, предъявляемые к дизельным топливам Электронные конфигурации атомов. Периодический Закон. Периодическая система Д.И. Менделеева. Химическая связь
Электронные конфигурации атомов. Периодический Закон. Периодическая система Д.И. Менделеева. Химическая связь 20230416_urok_na_20.02.2023
20230416_urok_na_20.02.2023 Химическая термодинамика. Термохимия
Химическая термодинамика. Термохимия Анализ и синтез химических веществ
Анализ и синтез химических веществ Обчислення об'ємних відношень газів за хімічними рівняннями. Хімія. 9 клас
Обчислення об'ємних відношень газів за хімічними рівняннями. Хімія. 9 клас Реконструкция установки получения элементарной серы
Реконструкция установки получения элементарной серы Метод электронного баланса для уравнивания окислительно-восстановительных реакций
Метод электронного баланса для уравнивания окислительно-восстановительных реакций Общие способы получения металлов
Общие способы получения металлов История развития промышленности переработки полимеров
История развития промышленности переработки полимеров Фізичні властивості та хімічний склад природних вод
Фізичні властивості та хімічний склад природних вод Активные формы кислорода. Антиоксиданты их физиологическая роль
Активные формы кислорода. Антиоксиданты их физиологическая роль Геохимия гранитоидов, зоны гипергенеза, осадочного процесса
Геохимия гранитоидов, зоны гипергенеза, осадочного процесса