Содержание
- 2. Железо Железо не только основа всего мира, самый главный металл окружающей нас природы, оно – основа
- 3. : Цели урока: 1. Научить на примере Феррума характеризовать элементы побочных подгрупп и изучить свойства железа.
- 4. Историческая
- 5. Аркаим – «страна городов» на Южном Урале - существовал на рубеже бронзового и железного веков
- 6. Плавка железа в Древнем Египте (воздух подаётся мехами, сшитыми из шкур животных)
- 9. Ковка железа Куй железо, пока горячо. Русская пословица.
- 10. Визитка химического элемента
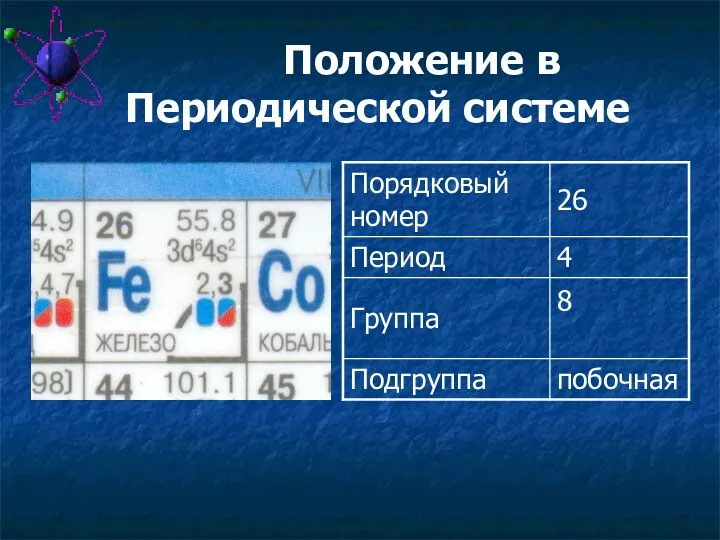
- 11. Положение в Периодической системе
- 12. Охарактеризуйте Fe как химический элемент, составив предложения со словами и словосочетаниями: Порядковый номер, номер периода ,
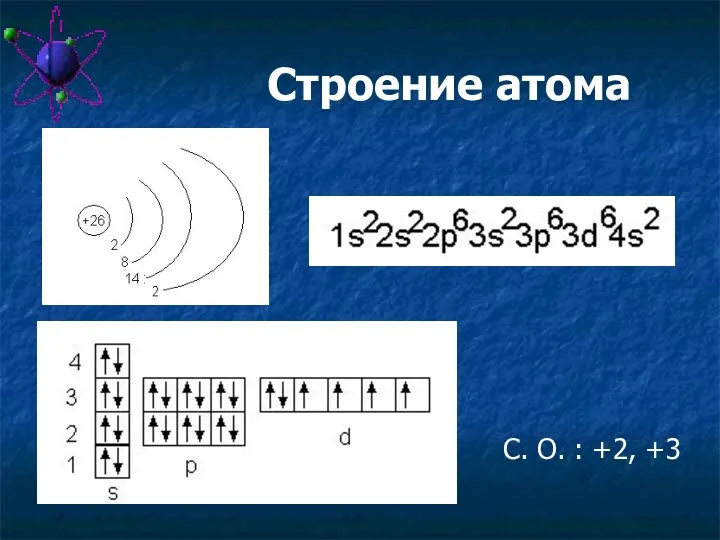
- 13. Строение атома С. О. : +2, +3
- 14. Геологическая
- 15. Природные соединения железа Fe FeS Пирит (железный или серный колчедан) FeCO3 Сидерит Fe2O3*3H2O Лимонит (бурый железняк)
- 16. Нахождение в природе Метеоритное железо
- 17. Нахождение в природе В свободном виде в метеоритах В живых организмах
- 18. В воде минеральных источников содержится сульфат и гидрокарбонат железа
- 19. В земной коре 5,1% железа, 2 место после алюминия. По запасам железных руд Россия занимает 1
- 20. Биологическая Железо входит в состав гемоглобина, миоглобина, различных ферментов и других сложных железо -белковых комплексов, которые
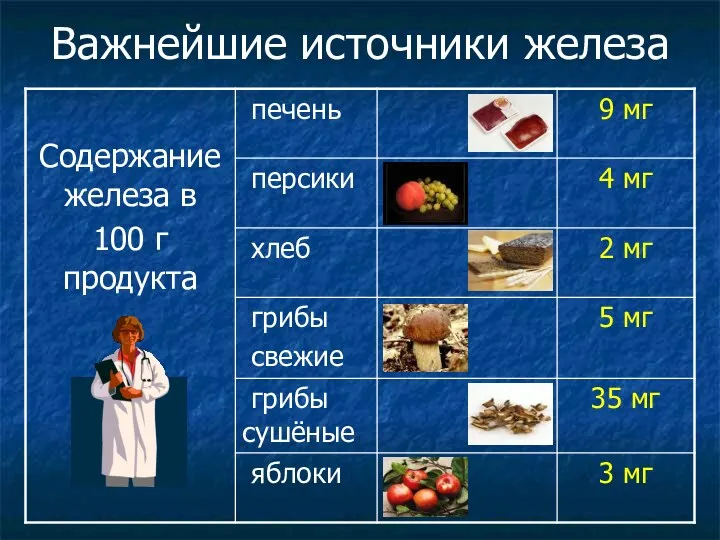
- 21. Важнейшие источники железа
- 22. Физическая
- 23. Физические свойства железа Серебристо-серый, мягкий металл, обладает хорошей пластичностью, ковкостью и способностью к намагничиванию. Плотность 7,864г/см3,
- 24. Физические свойства Железо - сравнительно мягкий ковкий серебристо-серый металл. Температура плавления – 1535 0С Температура кипения
- 25. Выберите и запишите цифры только тех свойств, которые не относятся к физическим свойствам железа: Серебристо-белый металл
- 26. Химическая
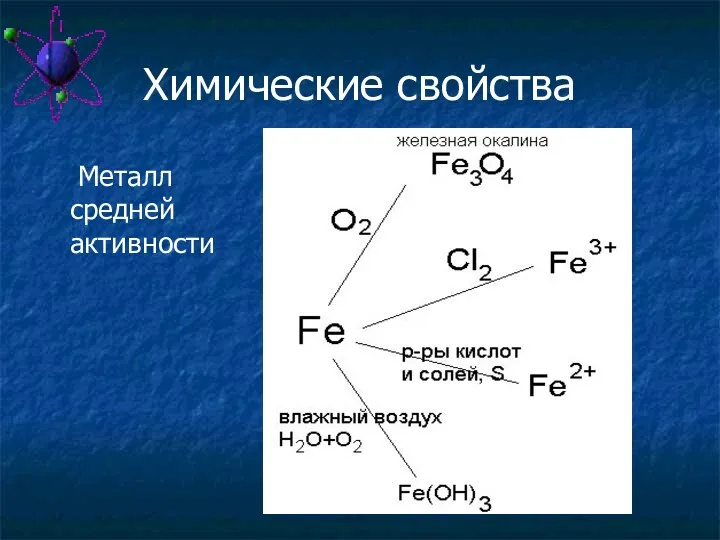
- 27. Химические свойства железа Взаимодействие железа с кислородом: Fe + O2 = Fe3O4 (FeO*Fe2O3) 3 2
- 28. Химические свойства железа Взаимодействие железа с хлором: Fe + Cl2 = FeCl3 2 3 2
- 29. Химические свойства При нагревании 2Fe + 3Cl2 =2FeCl3 3Fe +2O2= Fe3O4 (FeO Fe2O3) Fe +S =FeS
- 30. Химические свойства Металл средней активности
- 32. Скачать презентацию

























 Азотная кислота. Соли азотной кислоты. Получение и применение азотной кислоты. Урок 43
Азотная кислота. Соли азотной кислоты. Получение и применение азотной кислоты. Урок 43 Вирощення кристталів
Вирощення кристталів Высокомолекулярные вещества полимеры
Высокомолекулярные вещества полимеры Observing change. Chemical reactions
Observing change. Chemical reactions Осмий. Нахождение в природе
Осмий. Нахождение в природе Аммиак. Соли аммония
Аммиак. Соли аммония ПРИРОДНЫЕ ИСТОЧНИКИ УГЛЕВОДОРОДОВ
ПРИРОДНЫЕ ИСТОЧНИКИ УГЛЕВОДОРОДОВ Понятия и законы химии
Понятия и законы химии Методы получения органических галогенидов
Методы получения органических галогенидов Углеводороды из Башкортостана
Углеводороды из Башкортостана Брейн – ринг. Мини – ЕГЭ по химии
Брейн – ринг. Мини – ЕГЭ по химии Понятие о солях (8 класс)
Понятие о солях (8 класс) Методы разделения белковых смесей. Электрофорез
Методы разделения белковых смесей. Электрофорез Водород. Растворы. 8 класс
Водород. Растворы. 8 класс Новинки СН старт: июль 2016 Профессиональная химия PRO service
Новинки СН старт: июль 2016 Профессиональная химия PRO service Лекция 4. Физико-химические свойства растворов
Лекция 4. Физико-химические свойства растворов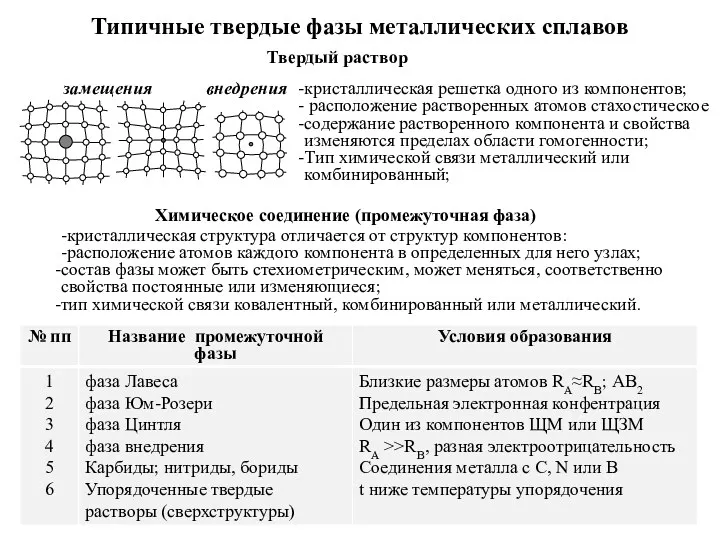 Типичные твердые фазы металлических сплавов
Типичные твердые фазы металлических сплавов Совместимость электродных материалов в новой электрохимической системе Li4Ti5O12/Li3V2(PO4)3 с традиционным электролитом для
Совместимость электродных материалов в новой электрохимической системе Li4Ti5O12/Li3V2(PO4)3 с традиционным электролитом для Crystal defects and imperfections
Crystal defects and imperfections Щёлочноземельные металлы
Щёлочноземельные металлы Аминокислоты
Аминокислоты Генетическая связь между основными классами неорганических веществ
Генетическая связь между основными классами неорганических веществ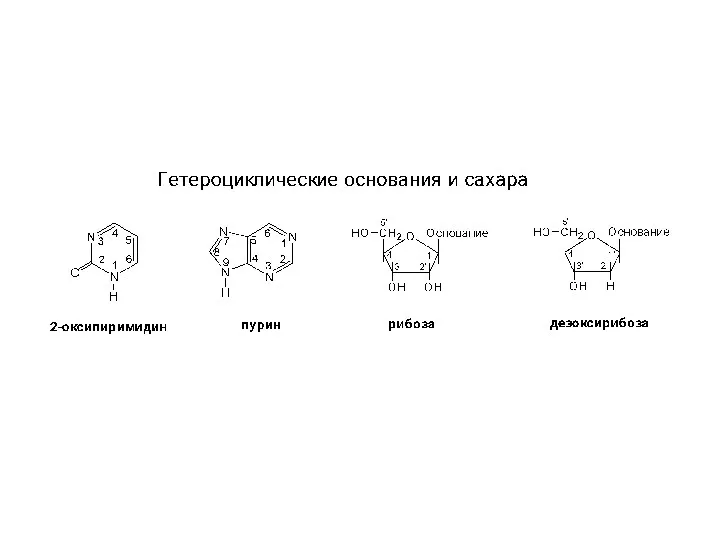 Структура гетероциклов, нуклеозидов и нуклеотидов
Структура гетероциклов, нуклеозидов и нуклеотидов Свойства жидких металлов
Свойства жидких металлов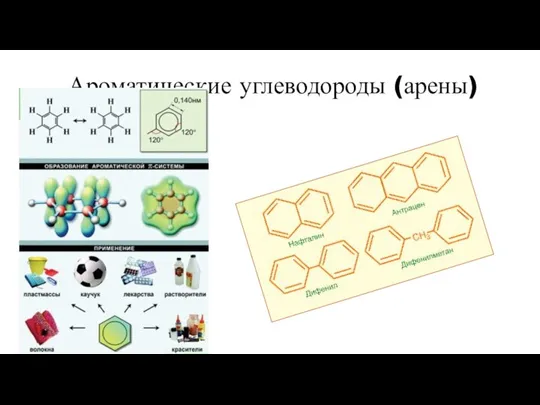 Ароматические углеводороды (арены)
Ароматические углеводороды (арены)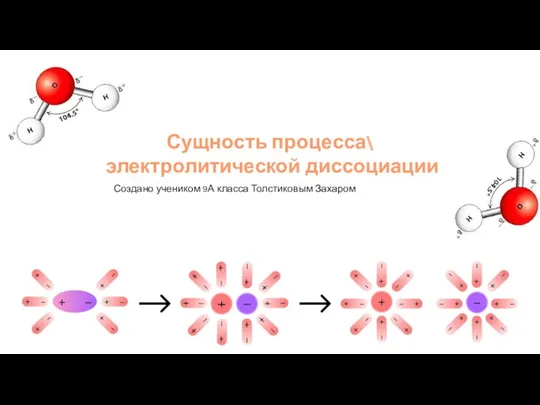 Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Химия и производство
Химия и производство Циклоалканы. Строение алициклов
Циклоалканы. Строение алициклов