Содержание
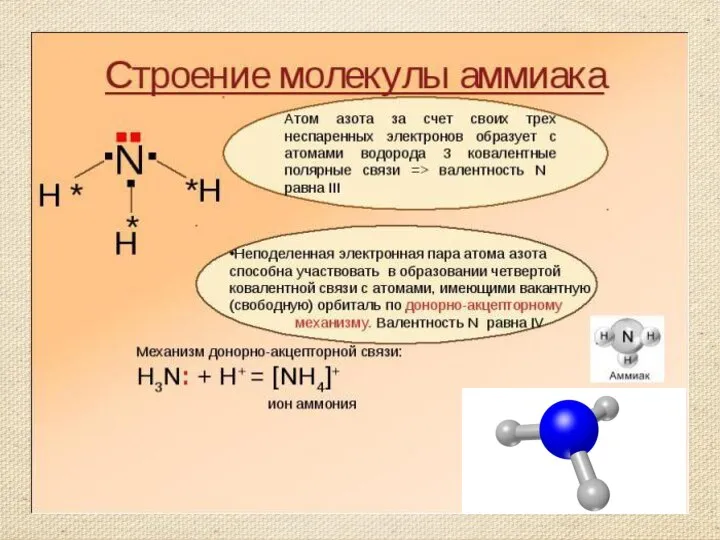
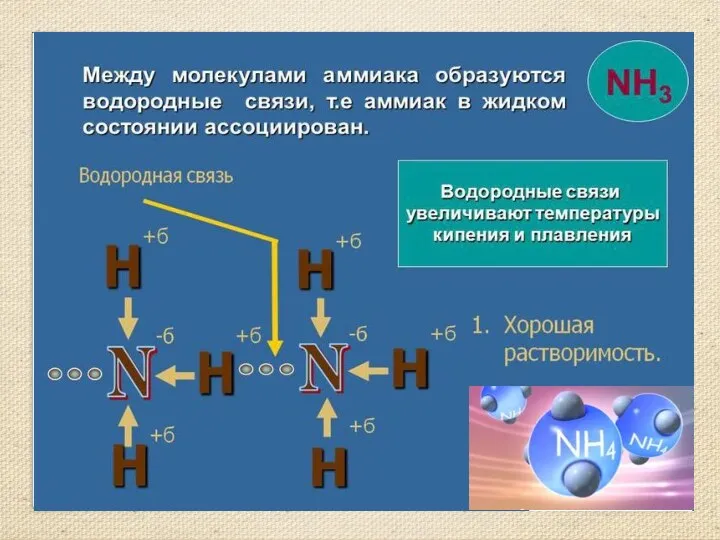
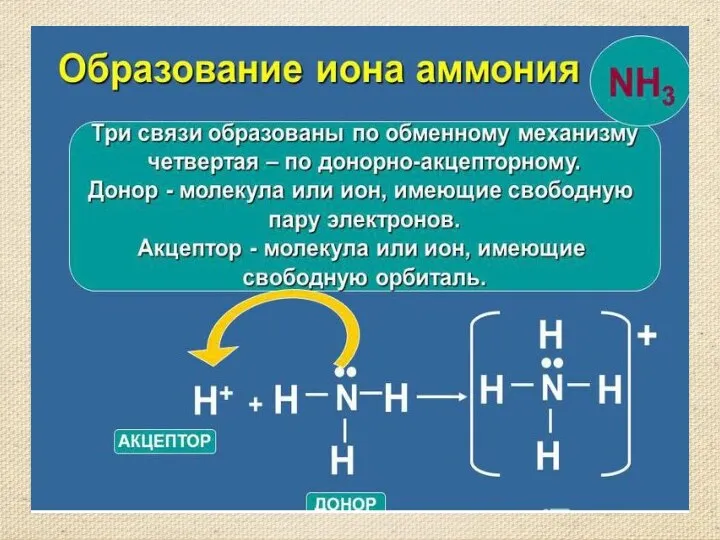
- 7. Строение молекулы аммиака. Молекулярная формула аммиака NH3 Электронная формула Структурная формула Масштабная модель
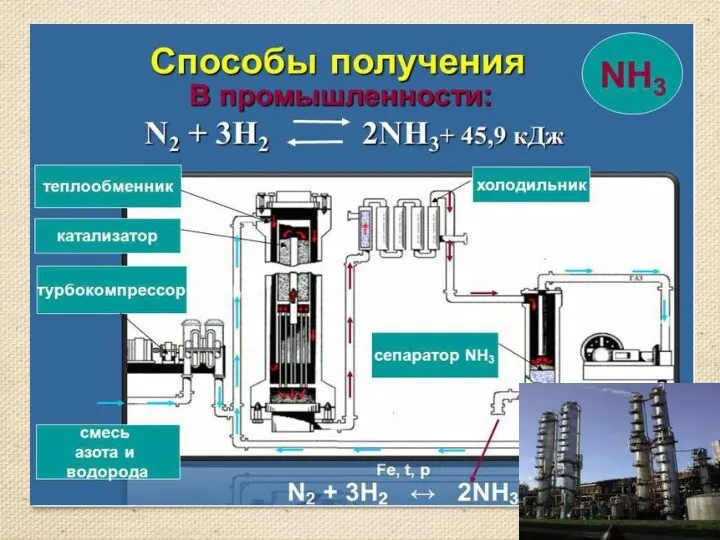
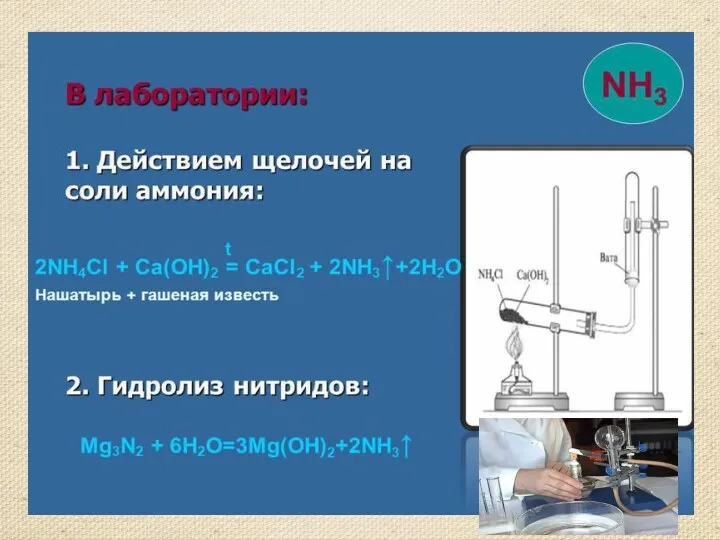
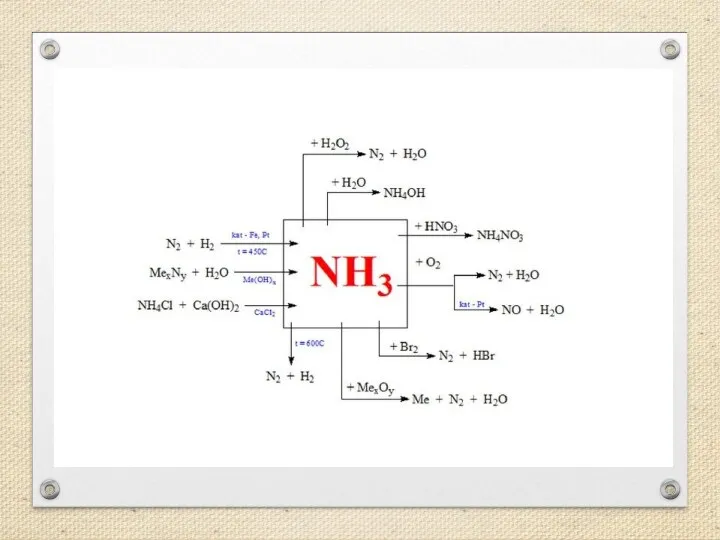
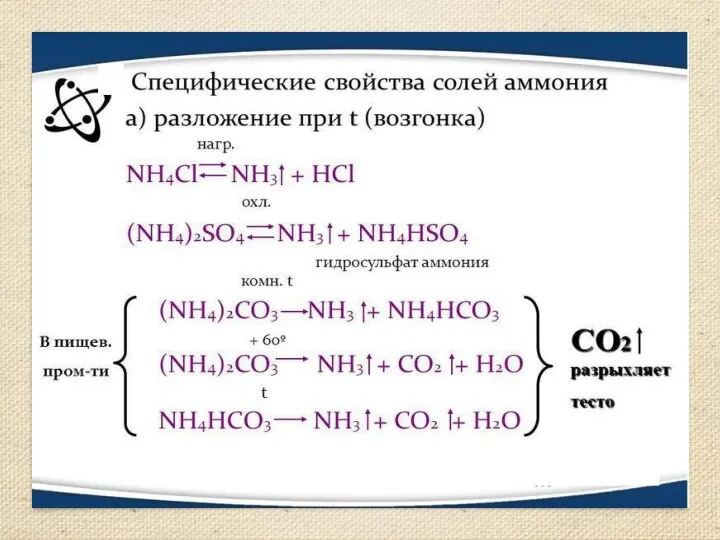
- 13. Получение аммиака Аммиак можно получить нагреванием смеси соли ‑ хлорида аммония и гидроксида кальция. При нагревании
- 16. Химические свойства аммиака. Аммиак-восстановитель Аммиак на воздухе не горит! Но в чистом кислороде он сгорает, окисляясь
- 19. с кислотами: Из сложных веществ аммиак реагирует Аммиак NH3 взаимодействует с концентрированными кислотами – соляной HCl,
- 31. Скачать презентацию





















 D-элементы: хром, молибден, вольфрам
D-элементы: хром, молибден, вольфрам Теория растворов. Диффузия в растворах. Коллигативные свойства растворов
Теория растворов. Диффузия в растворах. Коллигативные свойства растворов Игра по химии В рамках периодической таблицы
Игра по химии В рамках периодической таблицы Классификация химических реакций
Классификация химических реакций Непредельные углеводороды. Алкины
Непредельные углеводороды. Алкины Нуклеозиды. Нуклеиновые кислоты
Нуклеозиды. Нуклеиновые кислоты Полимеры
Полимеры Нефть. Способы её переработки. Фракции нефти
Нефть. Способы её переработки. Фракции нефти Жёсткость воды и способы её устранения
Жёсткость воды и способы её устранения Применение алканов
Применение алканов Основы химического равновесия
Основы химического равновесия Горючее, смазочные материалы и специальные жидкости
Горючее, смазочные материалы и специальные жидкости Кислородсодержащие соединения. Ароматические соединения
Кислородсодержащие соединения. Ароматические соединения Классификация полимеров
Классификация полимеров Спектроскопія ямр на ядрах 13с
Спектроскопія ямр на ядрах 13с Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості (10 клас)
Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості (10 клас) Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Свойства жидких металлов
Свойства жидких металлов Основные классы неорганических соединений. Тема 2
Основные классы неорганических соединений. Тема 2 Алюминий. Строение
Алюминий. Строение Обмен нуклеотидов
Обмен нуклеотидов Классификация, строение и номенклатура органически. Предмет органической химии
Классификация, строение и номенклатура органически. Предмет органической химии Органические производные титана со связью Ti-C
Органические производные титана со связью Ti-C Получение каталитического слоя на основе углеродных нанотрубок с наночастицами платины для водородно–воздушных топливных элементов
Получение каталитического слоя на основе углеродных нанотрубок с наночастицами платины для водородно–воздушных топливных элементов Биосинтез и катаболизм пуриновых и пиримидиновых нуклеотидов
Биосинтез и катаболизм пуриновых и пиримидиновых нуклеотидов Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Железо, его физические и химические свойства. Урок химии в 9 классе
Железо, его физические и химические свойства. Урок химии в 9 классе Фосфор и его соединения. Урок по химии для 9 класса
Фосфор и его соединения. Урок по химии для 9 класса