Содержание
- 2. Особенности химии d-элементов: все d-элементы являются металлами, но менее активными, чем s-металлы, металлы часто склонны к
- 3. Элементы VI группы (хром, молибден, вольфрам) В ряду Cr−Mo−W химическая активность металлов уменьшается. В ряду Cr−Mo-W
- 4. Свойства металлов VI группы Металлы склонны к пассивации.
- 5. Хром [Ar] 3d54s1. Характерные степени окисления +2, +3, +6. Наиболее характерна степень окисления +3. Хром –
- 6. Химические свойства хрома (продолжение) Может быть окислен в щелочном плаве: Cr + 3 KNO3 + 2
- 7. Получение хрома Минералы хрома: Получение феррохрома (60 % Cr, ~5 % C, ~8 % Si): FeCr2O4
- 8. Получение хрома 4 FeCr2O4 + 7 O2 + 8 Na2CO3 8 Na2CrO4 + 2 Fe2O3 +
- 9. Соединения Cr(0). Карбонильные комплексы хрома [Cr(CO)6] – бесцветное летучее соединение молекулярного строения. Получение прямым синтезом из
- 10. Нитрозил хрома. Металлорганические комплексы хрома [Cr(CO)6] + 4 NO → [Cr(NO)4] + 6 CO. NO –
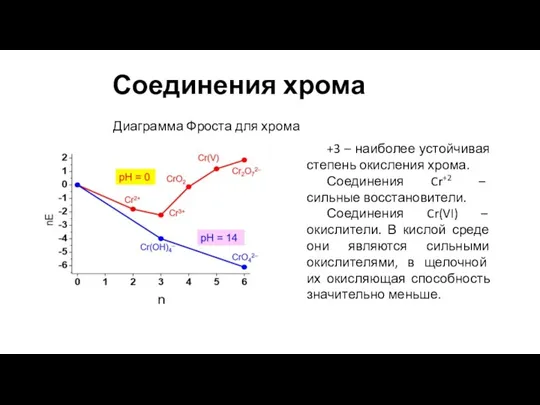
- 11. Соединения хрома Диаграмма Фроста для хрома +3 – наиболее устойчивая степень окисления хрома. Соединения Cr+2 –
- 12. Соединения Cr(II) Сильные восстановители Получение в растворе: Cr2(SO4)3 + Zn –(H+)→ 2 CrSO4 + ZnSO4 Неполное
- 13. Соединения Cr(II) − сильные восстановители 4 CrSO4 + O2 + 2 H2SO4 → 2 Cr2(SO4)3 +
- 14. Соединения Cr(III) В октаэдрическом кристаллическом поле электронная конфигурация (t2g)3(eg)0. Устойчивые, кинетически инертные комплексы. [Cr(H2O)6]3+ - фиолетовый
- 15. Оксид хрома (III) Твердый, химически инертный, структура корунда tпл = 2275 °С Практически не реагирует с
- 16. Гидроксид хрома (III) Cr2O3·xH2O Получение Cr2(SO4)3 + 6 NH3·H20 (р-р)→ 2 Cr(OH)3↓ + 3 (NH4)2SO4 Осадок
- 17. Гидролиз соединений Cr(III) Первая ступень гидролиза [Cr(H2O)6]3+ ⇄ [Cr(H2O)5OH]2+ + H+ (pKa = 4,8) Гидролиз соединений
- 18. Окислительно-восстановительные реакции соединений Cr(III) в растворах Cr(III) – самое устойчивое в окислительно-восстановительном отношении состояние хрома. Окисление
- 19. Координационные соединения Cr(III) Устойчивы, кинетически инертны. Чем больше Δо (10 Dq), тем устойчивее комплекс: [CrCl2(H2O)4]Cl +
- 20. Аммиакатные комплексы Cr(III) Получение: - в жидком аммиаке: CrCl3 + 6 NH3(ж) → [Cr(NH3)6]Cl3 (желтый) -
- 21. Хелатные комплексы Cr(III) K2Cr2O7 + 2 K2C2O4 + 7 H2C2O4 → 2 K3[Cr(C2O4)3] + 6 CO2
- 22. Соединения Cr(VI). Оксид хрома (VI) Фиолетово-красные кристаллы, tпл = 197 °С, tразл = 205 °С 2
- 23. Хромовые кислоты. Хроматы Хромовая кислота H2CrO4 – сильная кислота (pKa1 = -0,61; pKa2 =6,49) Поликонденсация хромовой
- 24. Окислительное действие соединений Cr(VI) Сильные окислители в кислой среде, крайне слабые – в щелочной: 6 (NH4)2[Fe(SO4)2]
- 25. Хлорпроизводные Cr(VI) K2Cr2O7 + 2 HCl –(холодный раствор)→ 2 KCrO3Cl + H2O (хлорхромат калия) K2Cr2O7 (кр)
- 26. Пероксидные соединения хрома K2Cr2O7 + 4 H2O2 + H2SO4-(экстракция амиловым спиртом, пиридином)→ 2 CrO(O2)2L + K2SO4
- 27. Молибден и вольфрам Химически менее активны, чем хром. Степень окисления +6 становится устойчивой и преобладает в
- 28. Получение молибдена и вольфрама Минералы: молибденит MoS2, шеелит CaWO4, вольфрамит (Fe,Mn)WO4 2 MoS2 + 7 O2
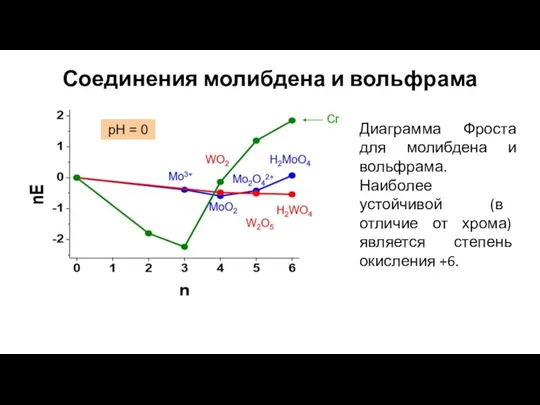
- 29. Соединения молибдена и вольфрама Диаграмма Фроста для молибдена и вольфрама. Наиболее устойчивой (в отличие от хрома)
- 30. Оксиды молибдена и вольфрама +6 Светло-желтые, слоистая структура. Слои составлены из октаэдров MO6 Нерастворимы в воде,
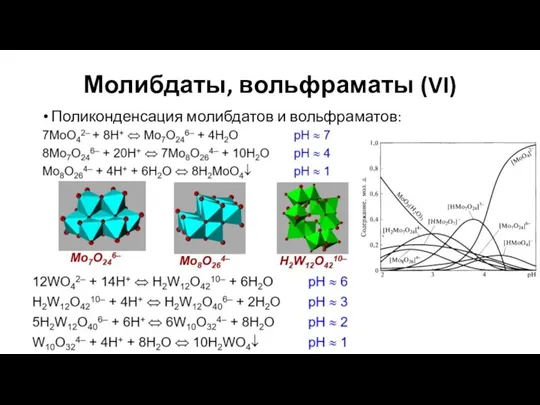
- 31. Молибдаты, вольфраматы (VI) Поликонденсация молибдатов и вольфраматов:
- 32. Гетерополисоединения молибдена и вольфрама Структура Кеггина – тетраэдрическое окружение гетероатома: Структура Доусона, производная от структуры Кеггина,
- 33. Соединения Mo(VI), W(VI) Сульфиды, тиосоли: Пероксидные соединения:
- 34. Восстановление соединений Mo(VI) и W(VI) Возможно лишь в кислой среде. Образование «синей» – разновалентных координационных соединений:
- 35. Молибденовые и вольфрамовые бронзы
- 37. Скачать презентацию



![Хром [Ar] 3d54s1. Характерные степени окисления +2, +3, +6. Наиболее](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/355616/slide-4.jpg)



![Соединения Cr(0). Карбонильные комплексы хрома [Cr(CO)6] – бесцветное летучее соединение](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/355616/slide-8.jpg)
![Нитрозил хрома. Металлорганические комплексы хрома [Cr(CO)6] + 4 NO →](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/355616/slide-9.jpg)





![Гидролиз соединений Cr(III) Первая ступень гидролиза [Cr(H2O)6]3+ ⇄ [Cr(H2O)5OH]2+ +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/355616/slide-16.jpg)
















 Процессы природного минералообразования. Формы природных выделений минералов
Процессы природного минералообразования. Формы природных выделений минералов 20191107_binarnye_oksidy_1
20191107_binarnye_oksidy_1 Основания
Основания Характер химического элемента по кислотно- основным свойствам. (Амфотерные соединения)
Характер химического элемента по кислотно- основным свойствам. (Амфотерные соединения) Химические свойства спиртов. Химические свойства предельных одноатомных спиртов
Химические свойства спиртов. Химические свойства предельных одноатомных спиртов Жаңа дәрілерді жасау
Жаңа дәрілерді жасау Реакции ионного обмена в растворах электролитов. рH раствора как показатель кислотности среды
Реакции ионного обмена в растворах электролитов. рH раствора как показатель кислотности среды Формулы веществ. Относительная атомная масса. Относительная молекулярная масса. Массовая доля элементов в сложных веществах
Формулы веществ. Относительная атомная масса. Относительная молекулярная масса. Массовая доля элементов в сложных веществах Спирты одноатомные и многоатомные
Спирты одноатомные и многоатомные Углерод
Углерод 20230306_oksidy
20230306_oksidy Химические свойства металлов. Электрохимический ряд напряжения металлов
Химические свойства металлов. Электрохимический ряд напряжения металлов Индикаторы на кухне
Индикаторы на кухне Развитие теории восстановления металлов
Развитие теории восстановления металлов Химическая связь
Химическая связь Экспериментальное решение задач по теме: Классы неорганических соединений
Экспериментальное решение задач по теме: Классы неорганических соединений Алкадиены
Алкадиены Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс)
Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс) Термопластичные полимеры
Термопластичные полимеры Сутектік көрсеткіш ph. Тұздар гидролизі
Сутектік көрсеткіш ph. Тұздар гидролизі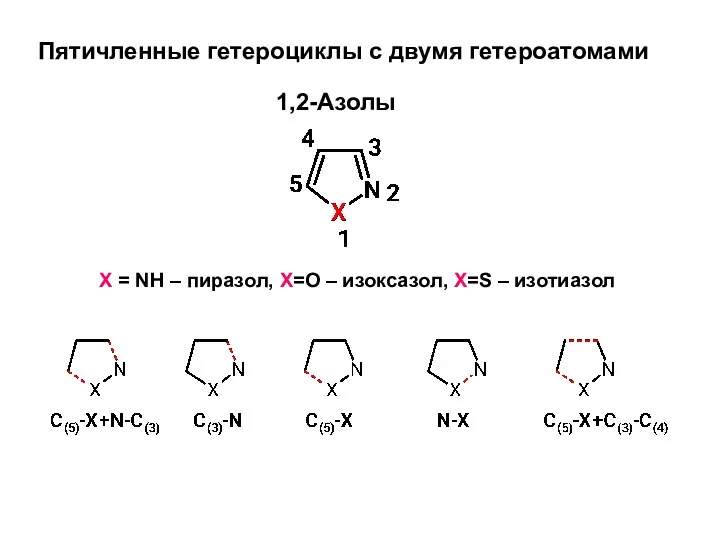 Пятичленные гетероциклы с двумя гетероатомами
Пятичленные гетероциклы с двумя гетероатомами Знакомство с образцами химических средств санитарии и гигиены
Знакомство с образцами химических средств санитарии и гигиены Периодический закон Д. И. Менделеева
Периодический закон Д. И. Менделеева Твердотільний ямр
Твердотільний ямр Оксид меди
Оксид меди Возникновение и развитие научной химии
Возникновение и развитие научной химии Технология получения многослойного и малослойного графена
Технология получения многослойного и малослойного графена Коррозия металлов
Коррозия металлов