Содержание
- 2. Проблема Можно ли варить кислые щи и хранить квашеную капусту в алюминиевой посуде? Можно ли мыть
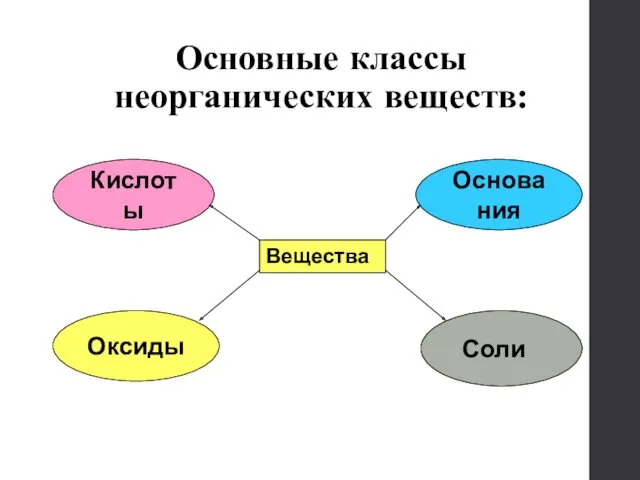
- 3. Основные классы неорганических веществ: Вещества Кислоты Основания Оксиды Соли
- 4. Выполните задание 1 в тетради Составьте формулы оксидов и гидроксидов, образованных следующими элементами, и назовите их:
- 5. О чем идет речь? К оксиду кальция воды прилить – Вмиг в гидроксид случится превращение. Так
- 6. О чем идет речь? Оксид кислотный – углекислый газ – С водой соединяется охотно, Хоть воду
- 7. ВЫВОД неметаллы кислотные оксиды кислоты металлы оснόвные оксиды основания
- 8. «Амфотерность» «амфо» или «амфи» (греч.) - означает: с двух сторон; и то, и другое; это вещества,
- 9. Какие элементы периодической системы образуют амфотерные соединения? Металлы Неметаллы, исключая элементы побочных подгрупп Элементы, образующие амфотерные
- 10. Выполните задание 4 в тетради Найдите в периодической системе химические элементы с амфотерными свойствами и назовите
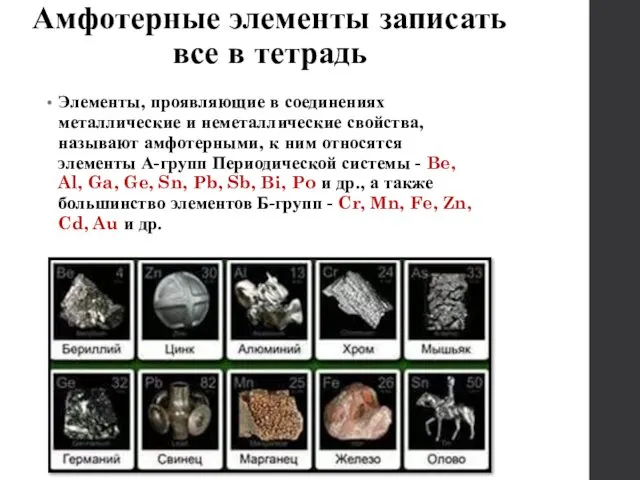
- 11. Амфотерные элементы записать все в тетрадь Элементы, проявляющие в соединениях металлические и неметаллические свойства, называют амфотерными,
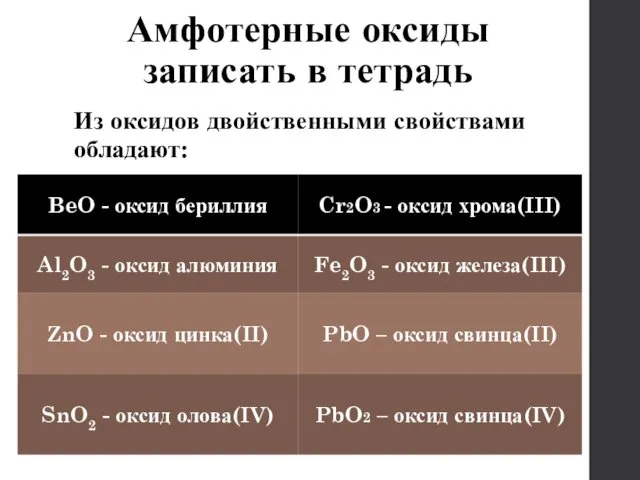
- 12. Амфотерные оксиды записать в тетрадь Из оксидов двойственными свойствами обладают:
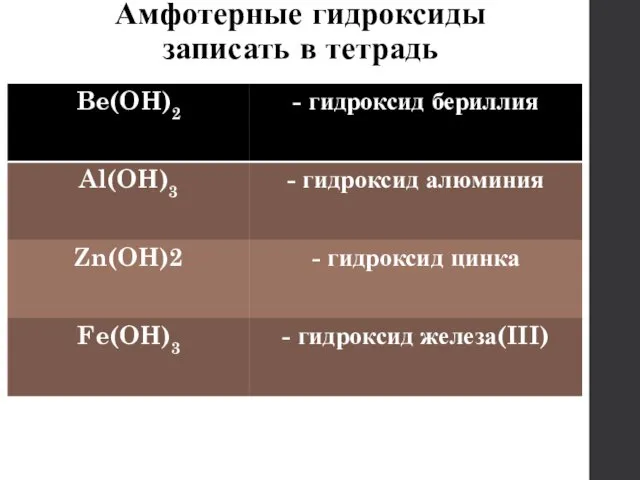
- 13. Амфотерные гидроксиды записать в тетрадь
- 14. Проблема Как доказать амфотерность оксида или гидроксида? Параграф 2, стр 10, 11 Задание 5: Записать практическую
- 15. Экспериментальная задача Цель работы: получить амфотерный гидроксид (на примере гидроксида цинка) и изучить его свойства.
- 16. Ход работы
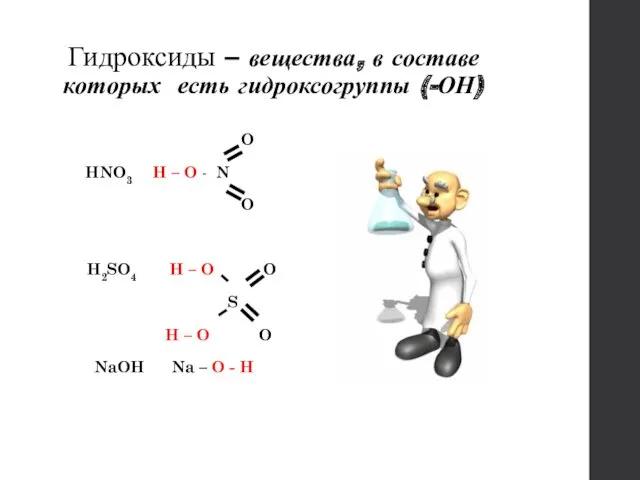
- 17. Гидроксиды – вещества, в составе которых есть гидроксогруппы (-ОН) O HNO3 H – O - N
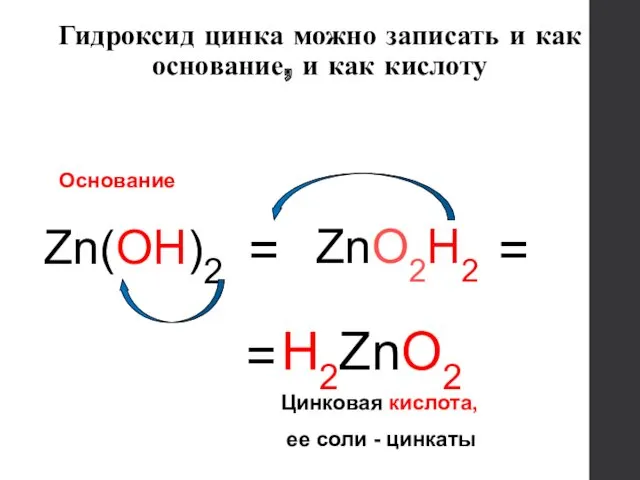
- 18. Гидроксид цинка можно записать и как основание, и как кислоту Zn(OH)2 = H2ZnO2 ZnO2H2 = =
- 19. Дополнение На самом деле, взаимодействие гидроксида цинка со щелочью с образованием средней соли – цинката натрия
- 20. Вывод Гидроксид цинка, взаимодействуя со щелочью, проявляет ________свойства, а взаимодействуя с кислотой, проявляет _________ свойства. Гидроксид
- 21. Оксид алюминия Al2O3 -оксид алюминия чрезвычайно распространенное на Земле вещество. Он составляет основу глины, бокситов, корунда
- 22. Проверим свои знания Задание : Вариант 1: составьте уравнения реакций взаимодействия оксида алюминия Al2O3 с соляной
- 23. Al2O3 + 6HCl = 2AlCl3 + 3H2O Al2O3 + 3NaOH = Na3AlO3 + 3H2O Как основный
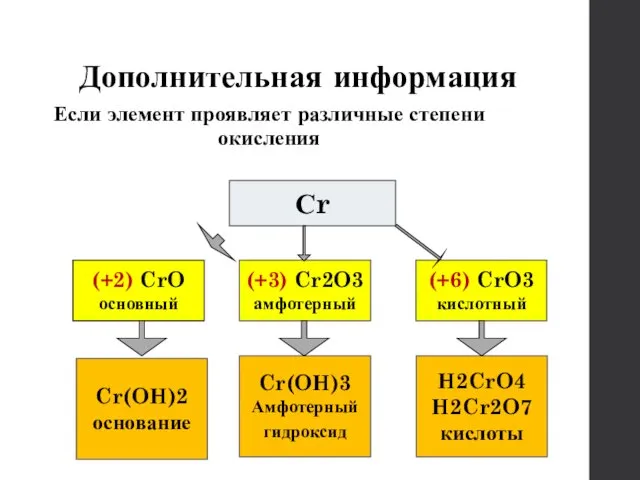
- 24. Дополнительная информация Если элемент проявляет различные степени окисления Сr (+2) CrO основный (+3) Cr2O3 амфотерный (+6)
- 25. Дополнительная информация элементы, которые образуют амфотерные соединения – оксиды и гидроксиды, могут и сами проявлять амфотерные
- 26. Проверим свои знания Отгадайте загадку: Вещество – универсал: Щелочь он парализует, Кислоту нейтрализует, И в реакции
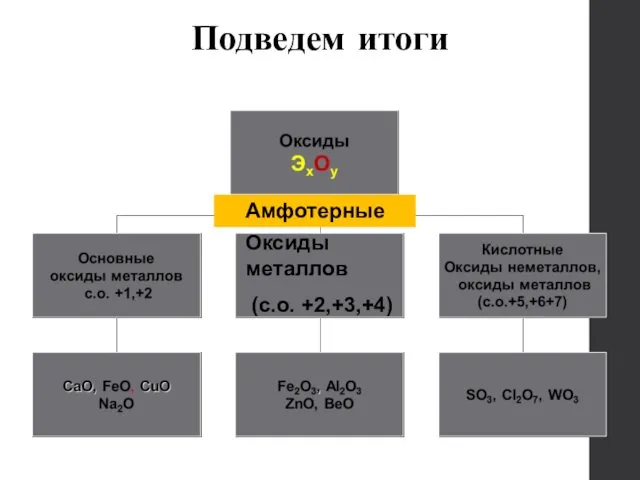
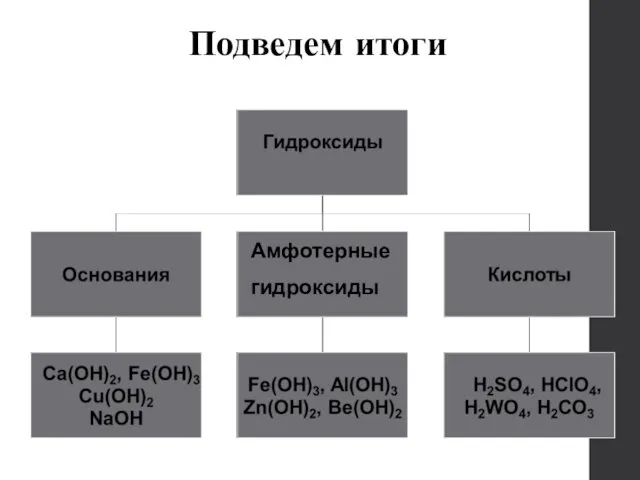
- 27. Амфотерные Оксиды металлов (с.о. +2,+3,+4) Подведем итоги
- 28. Амфотерные гидроксиды Подведем итоги
- 29. Вернемся к проблеме Можно ли варить кислые щи и хранить квашенную капусту в алюминиевой посуде? Можно
- 30. Вернемся к проблеме Ответ запиши в тетради
- 32. Скачать презентацию




















 Електролітична дисоціація. Гідроліз солей
Електролітична дисоціація. Гідроліз солей Группа веществ, изолируемых из биологического материала дистилляцией
Группа веществ, изолируемых из биологического материала дистилляцией Виды присадок к моторным топливам. Бензин
Виды присадок к моторным топливам. Бензин Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс
Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс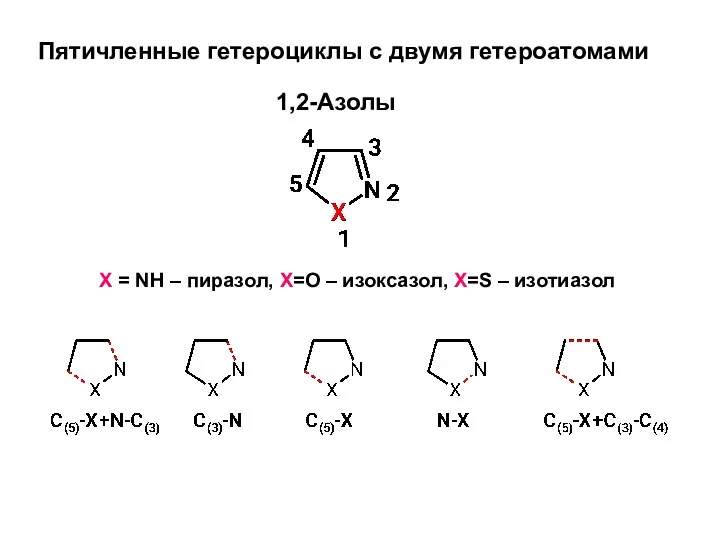 Пятичленные гетероциклы с двумя гетероатомами
Пятичленные гетероциклы с двумя гетероатомами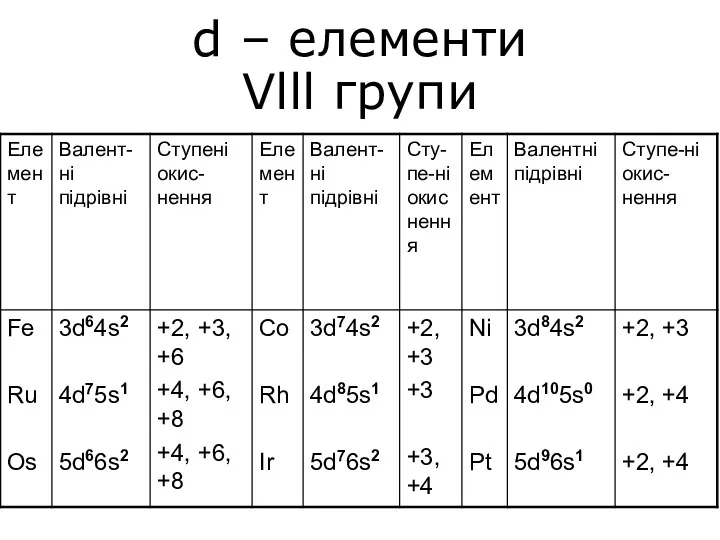 d – елементи Vlll групи
d – елементи Vlll групи Влияние спирта на здоровье человека
Влияние спирта на здоровье человека Сероводород и сульфиды
Сероводород и сульфиды Понятие о солях (8 класс)
Понятие о солях (8 класс) Природный газ и его свойства. Раздел 1
Природный газ и его свойства. Раздел 1 Тотығу-тотықсыздану титрлеу әдісі
Тотығу-тотықсыздану титрлеу әдісі Heavy metals
Heavy metals Валентность и степень окисления
Валентность и степень окисления Теоретические основы органической химии
Теоретические основы органической химии Научные основы и технологии зеленой химии
Научные основы и технологии зеленой химии Қанықпаған майлар және соның негізіндегі БАЗ
Қанықпаған майлар және соның негізіндегі БАЗ Алмастырылмайтын аминқышқылды алу биотехнологиясы
Алмастырылмайтын аминқышқылды алу биотехнологиясы Молярный объем газов
Молярный объем газов Наноалотропи карбону: класифікація, одержання та застосування
Наноалотропи карбону: класифікація, одержання та застосування Фенолы
Фенолы Состав, строение и свойства натурального каучука
Состав, строение и свойства натурального каучука Химиялық элементтердің табиғи топтары
Химиялық элементтердің табиғи топтары Вода. Растворимость, растворы
Вода. Растворимость, растворы Пищевые добавки
Пищевые добавки Хімічні властивості кисню. Реакції сполучення
Хімічні властивості кисню. Реакції сполучення Биологически важные вещества жиры
Биологически важные вещества жиры Полимеры и пластические массы
Полимеры и пластические массы Щелочные металлы
Щелочные металлы