Содержание
- 2. Щелочные металлы Литий(Li) Натрий(Na) Рубидий(Rb) Калий(K) Цезий(Cs) Франций(Fr)
- 3. Щелочны́е мета́ллы — это элементы главной подгруппы первой группы Периодической системы Д.И.Менделеева.
- 4. При взаимодействии щелочных металлов с водой образуется едкая щёлочь, отсюда и название.
- 5. На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону. Они легко отдают этот электрон,
- 7. Химические свойства Активно взаимодействуют почти со всеми неметаллами: 2M+H2=2MH (гидрид), 2M+Cl2=2MCl (хлорид), 2M+S=M2S (сульфид).
- 8. При взаимодействии с кислородом натрий образует пероксид: 2Na+O2=Na2O2.
- 9. Только литий образует оксид при взаимодействии с кислородом: 4Li+O2=2Li2O.
- 10. Все щелочные металлы активно взаимодействуют с водой, образуя щелочи и восстанавливая воду до водорода(Н): 2M+2HOH=2MOH+H2
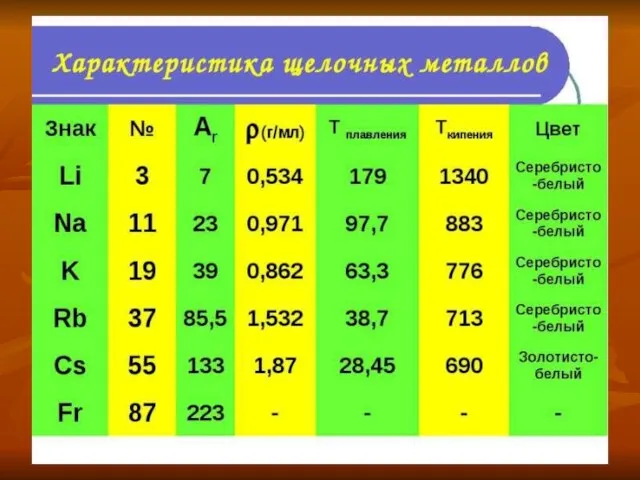
- 11. Физические свойства
- 12. Литий Был открыт в 1817 шведским химиком А. Арфведсоном; От греч. lithos — камень.
- 13. Натрий Название «натрий», происходящее от араб. натрун, греч. nitron, первоначально относилось к природной соде.
- 14. Рубидий Открыли в 1861 Р. Бунзен и Г. Кирхгоф. Название дано по цвету наиболее характерных красных
- 15. Калий Некоторые соединения Калия были известны уже в древности; однако их не отличали от соединений натрия.
- 16. Цезий Цезий открыт в 1860 Р. В. Бунзеном и Г. Р. Кирхгофом. Назван Цезий (от лат.
- 17. Франций Существование и главные свойства самого тяжёлого аналога щелочных металлов были предсказаны Д. И. Менделеевым в
- 18. Оксиды Оксиды M2O- твердые вещества, взаимодействующие с водой, кислотами и кислотными оксидами: 2Na+Na2O2=2Na2O
- 19. Гидроксиды Гидроксиды (МОН- твердые белые вещества) взаимодействуют с: Кислотами Кислотными оксидами Солями (если образуется нерастворимое основание).
- 20. Образование гидроксидов Оксид+Вода=Гидроксид K2O + H2O= 2KOH Горение калия(фиолетовым цветом)
- 21. Реакции с кислотами 2KOH + H2SO4 = K2SO4 + 2H2O соль +вода Хлорид калия
- 22. Реакции с солями 2NaOH + CuSO4 Cu(OH)2 + Na2SO4 нерастворимое основание + соль
- 23. Реакции с кислотными оксидами 2KOH + SiO2 = K2SiO3 + H2O соль + вода
- 25. Скачать презентацию





















 Количество вещества. Моль
Количество вещества. Моль Основы органической химии
Основы органической химии Методические рекомендации по изучению курса Коррозия и защита металлов
Методические рекомендации по изучению курса Коррозия и защита металлов Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ
Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ Кремний. Применение кремния
Кремний. Применение кремния Титанның химиялық элементі
Титанның химиялық элементі Твердое состояние вещества. Плавление
Твердое состояние вещества. Плавление Химиядан сұрақтар
Химиядан сұрақтар Кислород. Атом кислорода
Кислород. Атом кислорода Природные источники углеводородов
Природные источники углеводородов Қатты күйдегі препараттар
Қатты күйдегі препараттар Радиусы атомов и ионов
Радиусы атомов и ионов Теорія горіння та вибуху
Теорія горіння та вибуху Химия. Изучение жиров
Химия. Изучение жиров Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит
Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит Индикаторы кислотно-основного титрования
Индикаторы кислотно-основного титрования Solutions and solubilities
Solutions and solubilities Хімічні сполуки у побуті
Хімічні сполуки у побуті Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Физические, химические свойства предельных и непредельных карбоновых кислот, получение Кислородсодержащие органические соединения. Спирты. 10 класс
Кислородсодержащие органические соединения. Спирты. 10 класс Химическая связь
Химическая связь Как и где используется соляная кислота
Как и где используется соляная кислота Виды химической связи
Виды химической связи Вода. Растворимость, растворы
Вода. Растворимость, растворы Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Электролитическая диссоциация кислот, солей и оснований Степень электролитической диссоциации. Сильные и слабые электролиты
Электролитическая диссоциация кислот, солей и оснований Степень электролитической диссоциации. Сильные и слабые электролиты Обмоточные провода
Обмоточные провода Классификация химических реакций
Классификация химических реакций