Слайд 2

Классы неорганических соединений
Оксиды
Основания
Кислоты
Соли
Слайд 3

Оксиды сложные вещества состоящие из двух элементов один из которых кислород
CO
оксид углерода (II) N2O5 оксид азота(V)
Fe2O3 оксид железа(III) NO оксид азота (II)
Cl2O7 оксид хлора Al2O3 оксид алюминия
BaO оксид бария CaO оксид кальция
Слайд 4
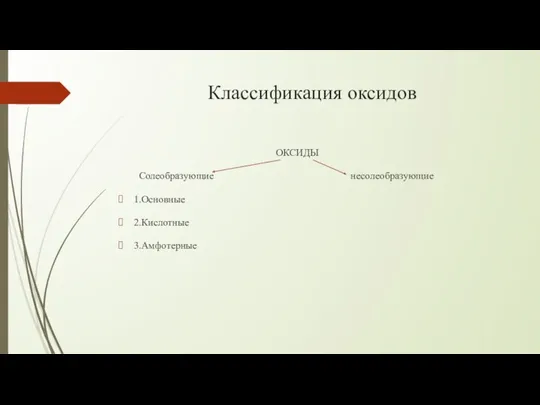
Классификация оксидов
ОКСИДЫ
Солеобразующие несолеобразующие
1.Основные
2.Кислотные
3.Амфотерные
Слайд 5

Основные оксиды
При взаимодействии с водой дают основания.
Это металлы
I и II группы, главной подгруппы и металлы побочных подгрупп с валентностью I и II( кроме оксида цинка и берилия)
Например Na2. CaO. CrO. MnO
Слайд 6

Кислотные оксиды
им соответствуют кислоты.
Это оксиды неметаллов, креме несолеобразующих.
Например:
SO3, CO2, Р2O5.
Слайд 7

Амфотерные оксиды
этим оксидам соответствуют и кислоты и основания, а это
оксиды металлов главных и побочных подгрупп с валентностью III, иногда IV, а также оксиды цинка и берилия.
Например: BeO ZnO Al2O3.
Слайд 8

Несолеобразующие оксиды
безразличные к кислотам и основаниям.
Это оксиды неметаллов
с валентностью I и II
например N2O, NO, CO
Слайд 9

Получение оксидов:
1.Горение веществ: а) простых 2 Mg +O2 =2 MgO
Б)
сложных 2H2S +3O2 =2H2O +2SO2
2. Разложение сложных веществ
CaCO3 =Cao +CO2
Zn(OH)2 = ZnO + H2O
H2SO3 = H2O +SO2
Слайд 10

Химические свойства основных оксидов
Основной оксид + кислотный оксид = соль
CaO +SO3
= CaSO4
Основной оксид + кислота = соль и вода
Na2O +HCL = NaCl +H2O
Основной оксид + вода = щелочь
CaO +H2O = Ca(OH)2
Слайд 11

Химические свойства кислотных оксидов
1.Кислотный оксид + вода = кислота
CO2 +H2O =
H2CO3
2. кислотный оксид + основание = соль + вода
CO2 +NaOH = Na2CO3 + H2O
3.Мение летучие вытесняют более летучие из соединений.
CaCO3 +SiO2 = CaSiO3 +CO2
Слайд 12

Химические свойства амфотерных оксидов
1.Взаимодействует как с кислотами так и с щелочами
2 HCl
+ ZnO = H2O + ZnCl2
2 NaOH + ZnO + H2O = Na2[Zn(OH)4] ( раствор)
2 NaOH + ZnO = Na2ZnO2 + H2O (сплавлении)











 Фосфор и его соединения
Фосфор и его соединения Химиялық байланыс және заттардың құрылымдық түрлі сатылары
Химиялық байланыс және заттардың құрылымдық түрлі сатылары Дистилляция и ректификация
Дистилляция и ректификация Металлы и их соединения
Металлы и их соединения Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение
Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение Кислородосодержащие производные углеводородов. Спирты. Фенолы. Простые эфиры
Кислородосодержащие производные углеводородов. Спирты. Фенолы. Простые эфиры Углеводы
Углеводы Металлическая связь
Металлическая связь Карбоновые кислоты. (Лекция 6.3)
Карбоновые кислоты. (Лекция 6.3) Стирка по научному
Стирка по научному Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов)
Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов) Спирты. Классификация, номенклатура, изомерия спиртов
Спирты. Классификация, номенклатура, изомерия спиртов Строение атома
Строение атома Углеводы, монозы, биозы. Лекция 15
Углеводы, монозы, биозы. Лекция 15 Атом – сложная частица
Атом – сложная частица Элементы пятой-А группы. Азот и фосфор
Элементы пятой-А группы. Азот и фосфор Идеальные и реальные кристаллы
Идеальные и реальные кристаллы Электрохимические процессы
Электрохимические процессы Ядерное топливо
Ядерное топливо Кислород. Оксиды. Валентность
Кислород. Оксиды. Валентность Палладий. История открытия химических веществ
Палладий. История открытия химических веществ Качественные реакции
Качественные реакции 20230219_prezentatsiya_k_uroku_neft
20230219_prezentatsiya_k_uroku_neft Аминокислоты, как структурные компоненты белков
Аминокислоты, как структурные компоненты белков Степень окисления. Составление химических формул бинарных соединений
Степень окисления. Составление химических формул бинарных соединений Основи. Фізичні властивості основ
Основи. Фізичні властивості основ Внеклассное мероприятие по химии. 9 класс
Внеклассное мероприятие по химии. 9 класс Водород. Характеристика положения водорода в ПСХЭ, строение атома и молекулы (8 класс)
Водород. Характеристика положения водорода в ПСХЭ, строение атома и молекулы (8 класс)