Содержание
- 2. Электроны, обладая свойствами волны и свойствами частицы, могут находится в любой части пространства вокруг ядра. Область
- 3. Ядра атомов состоят из протонов и нейтронов. Протон (р) – элементарная частица, обладающая «+» зарядом, равным
- 4. Число протонов в ядре характеризует его заряд (Z). Общее число протонов и нейтронов называют массовым числом
- 5. Разновидности химического элемента, имеющие одинаковое число протонов, но разное число нейтронов, называют изотопами (греч. «изос» -одинаковый,
- 6. Обозначение: верхний индекс – массовое число; нижний индекс – заряд ядра. 3517Cl 3717Cl
- 7. КВАНТОВЫЕ ЧИСЛА Главное квантовое число (n) Определяет возможные энергетические состояния электрона в атоме. n = 1
- 8. Наименьшей энергией электрон обладает при n =1, с увеличением n энергия электрона возрастает. Состояние электрона, которое
- 9. Определяет размер электронного облака (чем больше n, тем больше размер облака). Электроны, с одинаковым значением n,
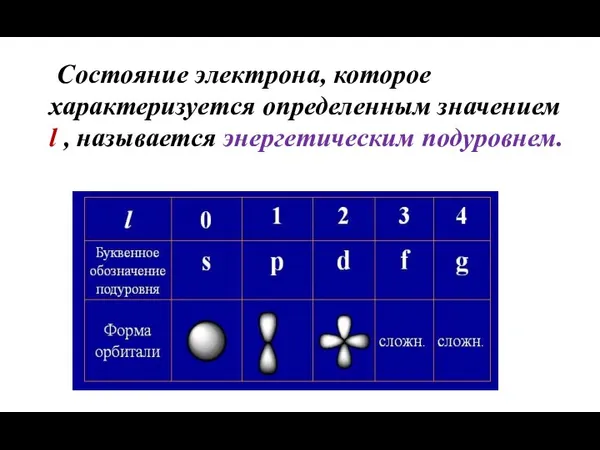
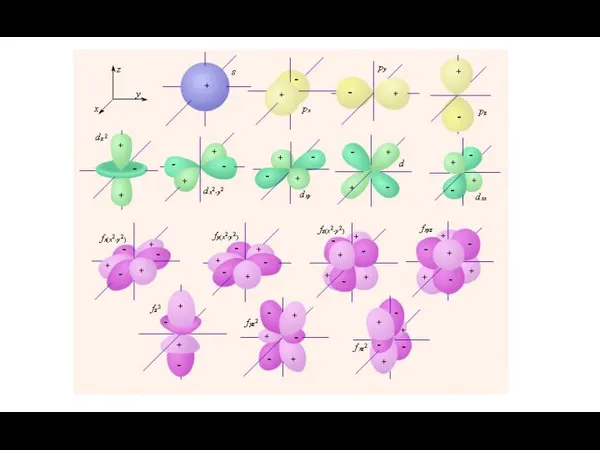
- 10. Орбитальное квантовое число (l) Форма электронного облака определяется орбитальным квантовым числом l, которое может принимать целочисленные
- 11. Состояние электрона, которое характеризуется определенным значением l , называется энергетическим подуровнем.
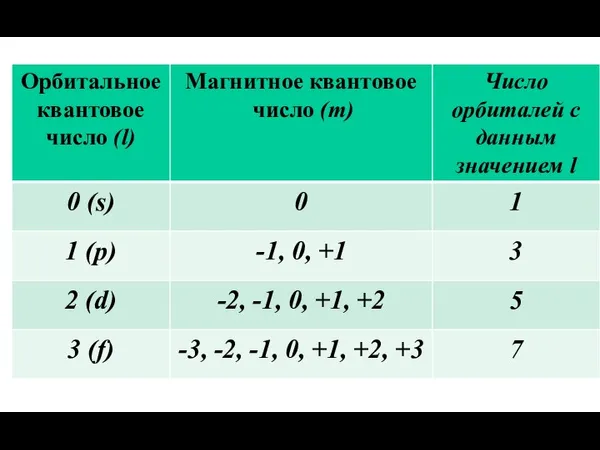
- 12. Магнитное квантовое число (m) Ориентация электронного облака в пространстве определяется значением магнитного квантового числа m. Принимает
- 13. Некоторому значение l соответствует (2l+1) возможных значений m, т.е. возможных способов расположения электронных облаков в пространстве.
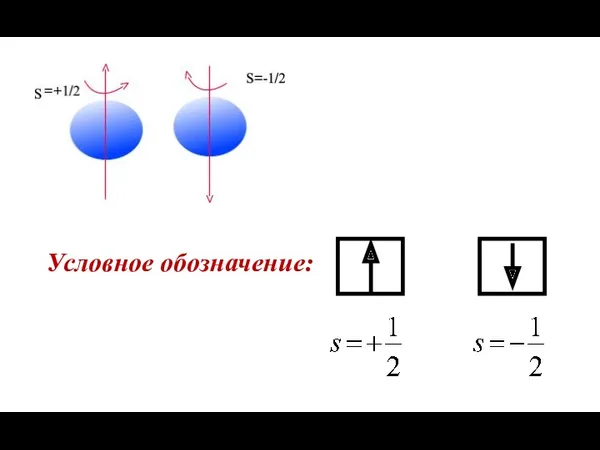
- 16. Спиновое квантовое число (s) Характеризует собственное вращательное движение электрона вокруг своей оси (от англ.«spin» - вращение,
- 17. Условное обозначение:
- 18. Многоэлектронные атомы. Распределение электронов по уровням, подуровням и атомным орбиталям Число электронов, вращающихся вокруг ядра, соответствует
- 19. Принцип наименьшей энергии (электрон, всегда стремится занять самый низкий энергетический уровень, т.е. вначале заполняются уровни с
- 20. 2. Принцип несовместимости (принцип Паули) – в атоме не может быть 2 электронов, характеризующихся одинаковыми значениями
- 21. Число электронов в энергетическом слое определяется значением гл. квантового числа по формуле: N = 2n2 В
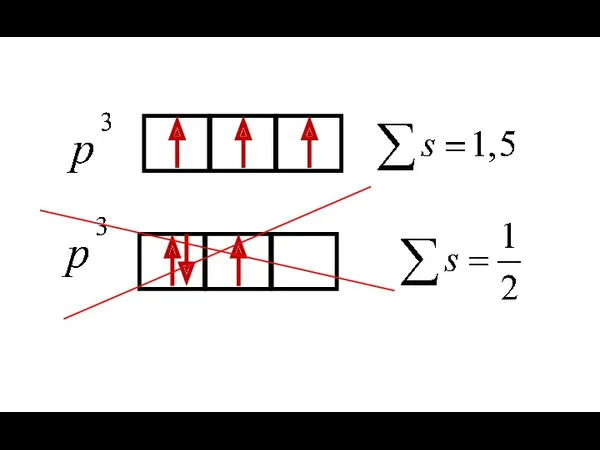
- 22. Правило Хунда – по атомным орбиталям электроны распределяются таким образом, чтобы обеспечить максимальное значение суммарного спинового
- 24. В соответствии с принципом наименьшей энергии и с помощью квантовых чисел получают т.н. «идеальный» ряд распределения
- 25. Правило Клечковского – вначале электронами заполняется тот подуровень, для которого минимальна сумма (n+l), при одинаковых значениях
- 26. 1 2 3 3 4 5 4 5 1+0 2+0 2+1 3+0 3+1 3+2 4+0 4+1
- 27. 7 8 9 7 8 9 10 6+1 6+2 6+3 7+0 7+1 7+2 7+3 6p6 6d10
- 28. В соответствии с правилом Клечковского формируется реальный ряд распределения электронов: 1s2 2s2 2p6 3s2 3p6 4s2
- 29. Электронные и электронно-структурные (графические) формулы Электронные формулы показывают распределение электронов по уровням и подуровням. Электронно-структурные –
- 30. Se (+34) 1s22s22p63s23p64s23d104p4 W=2 4s2 4p4 Валентность (W) определяется числом неспаренных электронов на внешнем уровне.
- 31. Число неспаренных электронов можно увеличить за счет дополнительной энергии и перевода атома в возбужденное состояние. Затраченная
- 32. Se * (+34) 1s22s22p63s23p64s23d104p34d1 W=4 4s2 4p3 4d1 Валентные возможности
- 33. Se * * (+34) 1s22s22p63s23p64s13d104p34d2 W=6 4s1 4p3 4d2
- 34. Zr (+40) 1s22s22p63s23p64s23d104p6 5s2 4d2 W=0 4d2 5s2
- 35. Zr *(+40) 1s22s22p63s23p64s23d104p6 5s1 4d25p1 W=4 4d2 5s1 5p1
- 36. Периодический закон Д.И. Менделеева (1869 г) И. Берцелиус (Швеция) в начале XIX века разделил все элементы
- 37. 3. В 1864 г. Дж. Ньюлендс (Англия) распределил все известные элементы в ряд, в порядке возрастания
- 38. Д.И. Менделеев в основу классификации положил атомный вес (атомную массу) элементов. Расположив все известные тогда (63)
- 39. Современная формулировка закона: Свойства элементов и их соединений находятся в периодической зависимости от положительного заряда ядра.
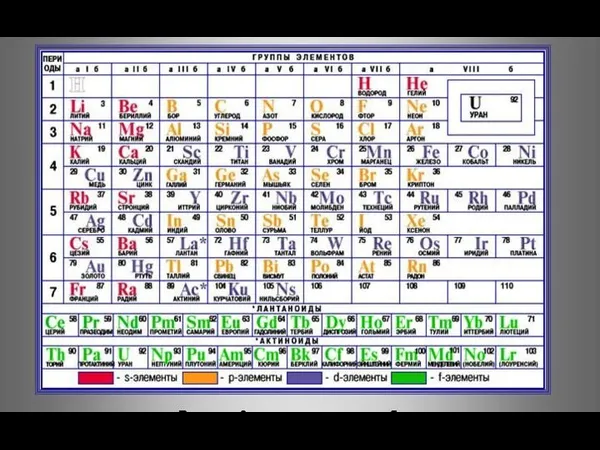
- 40. Структура периодической системы Система состоит из периодов и групп. Период составляют элементы, у которых заполняется электронами
- 42. Группу составляют элементы, имеющие одинаковое число валентных электронов. s и p –элементы помещены в группы по
- 43. Элементы каждой группы подразделяются на подгруппы: главную и побочную. Подгруппа – это вертикальный ряд элементов, имеющих
- 44. Главную подгруппу 8 группы составляют инертные (благородные) газы: He, Ne, Ar, Kr, Xe, Rn, имеющие строение
- 45. Свойства свободных атомов Зависимость атомных радиусов от заряда ядра имеет периодический характер. В пределах одного периода
- 46. При переходе к следующему периоду, радиусы атомов увеличиваются. В пределах подгруппы с возрастанием заряда ядра размеры
- 47. Способность атомов легко отдавать внешние электроны и превращаться в «+» -заряженные ионы является наиболее характерным химическим
- 48. В периодах энергия ионизации возрастает слева направо, что вызвано сжатием электронных оболочек атома вследствие увеличения заряда
- 49. Неметаллы наоборот характеризуются способностью присоединять электроны с образованием «-»-заряженных ионов. Энергия, которая выделяется при присоединении электрона
- 51. Скачать презентацию










































 Алены. Строение, изомерия, номенклатура
Алены. Строение, изомерия, номенклатура Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения
Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения Сладкая жизнь. Проектно-исследовательская работа
Сладкая жизнь. Проектно-исследовательская работа Электроотрицательность химических элементов
Электроотрицательность химических элементов Щелочи
Щелочи Теоретические основы органической химии
Теоретические основы органической химии Типы эмульсий. Фракционный состав нефти. Типы нефти
Типы эмульсий. Фракционный состав нефти. Типы нефти Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Тяжелые металлы
Тяжелые металлы Его Величество Железо
Его Величество Железо Кинетика химических реакций
Кинетика химических реакций Алюминий. 9 класс
Алюминий. 9 класс Вода – это жизнь!
Вода – это жизнь! Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ
Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ Аммиак: состав вещества, получение, применение, строение, свойства
Аммиак: состав вещества, получение, применение, строение, свойства СпиртыПростыеЭфиры-1
СпиртыПростыеЭфиры-1 Biochemistry. What is biochemistry?
Biochemistry. What is biochemistry? Основные классы неорганических соединений
Основные классы неорганических соединений Растворение. Растворы
Растворение. Растворы Гидролиз неорганических веществ - солей. (11 класс)
Гидролиз неорганических веществ - солей. (11 класс) Строение атома
Строение атома Электролиз
Электролиз Углеводородное сырье для промышленности органических веществ. Лекция 1. Часть 1
Углеводородное сырье для промышленности органических веществ. Лекция 1. Часть 1 Электролиз: его применение
Электролиз: его применение Metal–metal multiple bonded intermediates in catalysis
Metal–metal multiple bonded intermediates in catalysis Химический элемент водород
Химический элемент водород Гидролиз органических и неорганических соединений
Гидролиз органических и неорганических соединений Хроматографические методы анализа
Хроматографические методы анализа